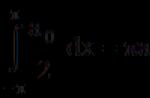49. Упрощенная схема гидролиза крахмала и гликогена в животном организме.
50. Гликолиз и его основные стадии. Значение гликолиза.
Сущность, суммарные реакции и КПД гликолиза.
Роль углеводного обмена. Источники глюкозы и пути ее использования в организме.
Основная роль углеводов определяется их энергетической функцией.
Глюко́за (от др.-греч. γλυκύς сладкий ) (C 6 H 12 O 6), или виноградный сахар - это белое или бесцветное вещество без запаха, имеющее сладкий вкус, растворимое в воде. Тростниковый сахар приблизительно на 25% слаще глюкозы. Глюкоза является самым важным для человека углеводом. В организме человека и животных глюкоза является основным и наиболее универсальным источником энергии для обеспечения метаболических процессов. Глюкоза депонируется у животных в виде гликогена, у растений - в виде крахмала.
Источники глюкозы
В обычных условиях основным источником углеводов для человека являются углеводы пищи. Суточная потребность в углеводах составляет примерно 400 г. В процессе усвоения пищи все экзогенные полимеры углеводной природы расщепляются до мономеров, во внутреннюю среду организма из кишечника поступают лишь моносахариды и их производные.
Глюкоза крови является непосредственным источником энергии в организме. Быстрота ее распада и окисления, а также возможность быстрого извлечения из депо обеспечивают экстренную мобилизацию энергетических ресурсов при стремительно нарастающих затратах энергии в случаях эмоционального возбуждения, при интенсивных мышечных нагрузках и др.
Уровень глюкозы в крови составляет 3,3-5,5 ммоль/л (60- 100 мг%) и является важнейшей гомеостатической константой организма. Особенно чувствительной к понижению уровня глюкозы в крови (гипогликемия) является ЦНС. Незначительная гипогликемия проявляется общей слабостью и быстрой утомляемостью. При снижении уровня глюкозы в крови до 2,2-1,7 ммоль/л (40- 30 мг%) развиваются судороги, бред, потеря сознания, а также вегетативные реакции: усиленное потоотделение, изменение просвета кожных сосудов и др. Это состояние получило название «гипогликемическая кома». Введение в кровь глюкозы быстро устраняет данные расстройства.
Энергетическая роль глюкозы.
1. В клетках глюкоза используется как источник энергии. Основная часть глюкозы, пройдя ряд преобразований, расходуется на синтез АТФ в процессе окислительного фосфорилирования. Более 90% углеводов расходуется для выработки энергии в процессе гликолиза.
2. Дополнительный путь энергетического использования глюкозы – без образования АТФ. Этот путь получил название пентозофосфатного. В печени он составляет около 30% преобразования глюкозы, в жировых клетках – несколько больше. Эта энергия расходуется для образования НАДФ, который служит донором водорода и электронов, необходимых для синтетических процессов – образования нуклеиновых и желчных кислот, стероидных гормонов.
3. Превращение глюкозы в гликоген или жир происходит в клетках печени и жировой ткани. Когда запасы углеводов низки, например, при стрессе, развивается глюнеогенез – синтез глюкозы из аминокислот и глицерина.
Схема использования глюкозы в организме
Метаболизм углеводов в организме человека состоит из следующих процессов:
1. Расщепление в пищеварительном тракте поступающих с пищей поли- и дисахаридов до моносахаридов, дальнейшее всасывание моносахаридов из кишечника в кровь.
2. Синтез и распад гликогена в тканях (гликогенез и гликогенолиз), прежде всего в печени.
Гликоген - основная форма депонирования глюкозы в клетках животных. У растений эту же функцию выполняет крахмал. В структурном отношении гликоген, как и крахмал, представляет собой разветвленный полимер из глюкозы. Однако гликоген более разветвлен и компактен. Ветвление обеспечивает быстрое освобождение при распаде гликогена большого количества концевых мономеров.
Роль гликогена:
Является основной формой хранения глюкозы в животных клетках
Образует энергетический резерв, который может быть быстро мобилизован при необходимости восполнить внезапный недостаток глюкозы
Откладывается в виде гранул в цитоплазме во многих типах клеток (главным образом печени и мышц)
Только гликоген, запасённый в клетках печени, может быть переработан в глюкозу для питания всего организма. Общая масса гликогена в печени может достигать 100-120 граммов у взрослых
Гликоген печени никогда не расщепляется полностью
В мышцах гликоген перерабатывается в глюкозо-6-фосфат, исключительно для локального потребления. В мышцах гликогена накапливается не более 1 % от общей массы мышц
Небольшое количество гликогена обнаружено в почках, и ещё меньшее - в глиальных клетках мозга и лейкоцитах
Синтез и распад гликогена не являются обращением друг в друга, эти процессы происходят разными путями.
 Молекула гликогена содержит до 1 млн. остатков глюкозы, следовательно, на синтез расходуется значительное количество энергии. Необходимость превращения глюкозы в гликоген связана с тем, что накопление значительного количества глюкозы в клетке привело бы к повышению осмотического давления, так как глюкоза хорошо растворимое вещество. Напротив, гликоген содержится в клетке в виде гранул, и мало растворим.
Молекула гликогена содержит до 1 млн. остатков глюкозы, следовательно, на синтез расходуется значительное количество энергии. Необходимость превращения глюкозы в гликоген связана с тем, что накопление значительного количества глюкозы в клетке привело бы к повышению осмотического давления, так как глюкоза хорошо растворимое вещество. Напротив, гликоген содержится в клетке в виде гранул, и мало растворим.
Синтез гликогена :
Гликоген синтезируется в период пищеварения (в течение 1-2 часов после приема углеводной пищи). Гликогенез особенно интенсивно протекает в печени и скелетных мышцах.
Для включения 1 остатка глюкозы в цепь гликогена тратится 1 АТФ и 1 УТФ
Основной активатор – гормон ИНСУЛИН
Распад гликогена :
Активизируется в промежутках между приемами пищи и при физической работе, когда снижается уровень глюкозы в крови (относительная гипогликемия)
Основные активаторы распада:
в печени – гормон ГЛЮКАГОН
в мышцах – гормон АДРЕНАЛИН
Упрощенная схема гидролиза крахмала и гликогена в животном организме .

3. Пентозофосфатный путь (пентозный цикл) - анаэробный путь прямого окисления глюкозы.
По этому пути идет не более 25-30% глюкозы поступившей в клетки
Итоговое уравнение пентозофосфатного пути :
6 молекул глюкозы + 12 НАДФ → 5 молекул глюкозы + 6 СО2 + 12 НАДФН2
Биологическая роль пентозофосфатного пути у взрослого человека состоит в выполнении двух важных функций:
· он является поставщиком пентоз, которые необходимы для синтеза нуклеиновых кислот, коферментов, макроэргов для пластических целей.
· служит источником НАДФН2, который, в свою очередь, используется для:
1. восстановительных синтезов стероидных гормонов, жирных кислот
2. активно участвует в обезвреживании токсичных веществ в печени
4. Гликолиз - распад глюкозы. Первоначально под этим термином обозначали только анаэробное брожение, которое завершается образованием молочной кислоты (лактата) или этанола и углекислого газа. В настоящее время понятие «гликолиз» используется более широко для описания распада глюкозы, проходящего через образование глюкозо-6-фосфата, фруктозодифосфата и пирувата как в отсутствии, так и в присутствии кислорода. В последнем случае употребляется термин «аэробный гликолиз», в отличие от «анаэробного гликолиза», завершающегося образованием молочной кислоты или лактата.
ГЛИКОЛИЗ
Маленькая незаряженная молекула глюкозы способна путем диффузии покидать клетку. Чтобы глюкоза оставалась в клетке, ее надо перевести в заряженную форму (обычно глюкозо-6-фосфат). Эта реакция называется блокирующей, или запирающей.
Дальнейшие пути использования глюкозо-6-фосфата в клетках:
Гликолиз и полное аэробное окисление глюкозы
Пентозофосфатный цикл (частичное окисление глюкозы до пентоз)
Синтез гликогена и т.д.
Гликолиз происходит в цитоплазме клеток. Конечным продуктом этого этапа является пировиноградная кислота.
АНАЭРОБНЫЙ ГЛИКОЛИЗ – процесс расщепления глюкозы с образованием конечного продукта лактата через пируват. Он протекает без использования кислорода и поэтому не зависит от работы митохондриальной дыхательной цепи.
Протекает в мышцах при выполнении интенсивных нагрузок, в первые минуты мышечной работы, в эритроцитах (в которых отсутствуют митохондрии), а также в разных органах в условиях ограниченного снабжения их кислородом, в том числе в опухолевых клетках. Этот процесс служит показателем повышенной скорости деления клеток при недостаточной обеспеченности их системой кровеносных сосудов.
Стадии гликолиза.
1. Подготовительная стадия (протекает с затратой двух молекул АТФ)
Глюкоза+2АТФ→глюкозо-6-фосфат→фруктозо-1,6-дифосфат
Ферменты: глюкокиназа; фосфофруктоизомераза;
2. Стадия образования триоз (расщепление глюкозы на 2 трехуглеродных фрагмента)
Фруктозо-1,6-дифосфат→ 2 глицероальдегид-3-фосфат
3. Окислительная стадия гликолиза (дает 4 моль АТФ на 1 моль глюкозы)
2 глицероальдегид-3-фосфата+2НАД+→2 ПВК +2 АТФ
2 ПВК + 2 НАДН*Н+→2 лактата + 2НАД+
2НАД дает 6 АТФ
Такой способ синтеза АТФ, осуществляющийся без участия тканевого дыхания и, следовательно, без потребления кислорода, обеспеченный запасом энергии субстрата, называется анаэробным, или субстратным, фосфорилированием .
Это самый быстрый путь получения АТФ. При этом следует учесть, что на первых стадиях расходуется две молекулы АТФ на активацию глюкозы и фруктозо-6-фосфата. В итоге превращение глюкозы в пируват сопровождается синтезом восьми молекул АТФ.
Общее уравнение гликолиза выглядит так:
Глюкоза + О2 + 8АДФ + 8 Н3 РО4 → 2 Пируват + 2Н2О + 8 АТФ,
Значение гликолиза:
1. Гликолиз представляет собой независимый от митохондрий путь получения АТФ в цитоплазме (2 моль АТФ на 1 моль глюкозы). Основное физиологическое значение – использование энергии, которая освобождается в этом процессе для синтеза АТФ. Метаболиты гликолиза используются для синтеза новых соединений (нуклеозидов; аминокислот: серин, глицин, цистеин).
2. Если гликолиз протекает до лактата, то в процессе происходит «регенерация» НАД+ без участия тканевого дыхания
3. В клетках, не содержащих митохондрий (эритроциты, сперматозоиды), гликолиз является единственным способом синтеза АТФ
4. При отравлении митохондрий угарным газом и другими дыхательными ядами гликолиз позволяет выжить
Регуляция гликолиза:
1. Скорость гликолиза снижается, если в клетку не поступает глюкоза (регуляция количеством субстрата), однако вскоре начинается распад гликогена и скорость гликолиза восстанавливается
2. АМФ (сигнал недостатка энергии)
3. Регуляция гликолиза с помощью гормонов. Стимулируют гликолиз: Инсулин, Адреналин (стимулирует распад гликогена; в мышцах при этом образуется глюкозо-6 фосфат и происходит активация гликолиза субстратом). Ингибирует гликолиз: Глюкагон (репрессирует ген пируваткиназы; переводит пируваткиназу в неактивную форму)
Смысл анаэробного гликолиза кратко
- В условиях интенсивной мышечной работы, при гипоксии (например, интенсивный бег на 200м в течении 30 с) распад углеводов временно протекает в анаэробных условиях
- Молекулы НАДН не могут отдать свой водород, так как «не работают» дыхательная цепь в митохондриях
- Тогда в цитоплазме хорошим акцептором водорода является пируват - конечный продукт 1-го этапа
- В состоянии покоя, наступающего после интенсивной мышечной работы, в клетку начинает поступать кислород
- Это приводит к «запуску» дыхательной цепи
- В результате чего анаэробный гликолиз тормозится автоматически и переходит на аэробный, более энергетически выгодный
- Торможение анаэробного гликолиза поступившим в клетку кислородом называется ЭФФЕКТОМ ПАСТЕРА
ЭФФЕКТ ПАСТЕРА. Заключается в угнетении дыханием (О 2) анаэробного гликолиза, т.е. происходит переключение с аэробного гликолиза на анаэробное окисление. Если ткани снабжены О 2 , то 2НАДН 2 , образовавшийся в процессе центральной реакции оксидоредукции, окислится в дыхательной цепи, поэтому ПВК не превращается в лактат, а в ацетил-КоА, который вовлекается в ЦТК.
Первый этап распада углеводов – анаэробный гликолиз - практически обратим. Из пирувата, а также из возникающего в анаэробных условиях лактата (молочная кислота), может синтезироваться глюкоза, а из неё гликоген.
Сходство анаэробного и аэробного гликолиза заключается в том, что до стадии образования ПВК эти процессы протекают одинаково при участии тех же ферментов.
ПОЛНОЕ АЭРОБНОЕ ОКИСЛЕНИЕ ГЛЮКОЗЫ (ПАОГ):
Благодаря активности митохондрий, можно полностью окислить глюкозу до углекислого газа и воды.
В этом случае гликолиз является первым этапом окислительного метаболизма глюкозы.
Перед включением митохондрий в ПАОГ следует превратить гликолитический лактат в ПВК.
Основные этапы ПАОГ:
1. Гликолиз с последующим превращением 2 моль лактата в 2 моль ПВК и транспортом протонов в митохондрию
2. Окислительное декарбоксилирование 2 моль пирувата в митохондриях с образованием 2 моль ацетилСоА
3.Сгорание ацетильного остатка в цикле Кребса (2 оборота цикла Кребса)
4. Тканевое дыхание и окислительное фосфорилирование: используются НАДН*Н+ и ФАДН2, генерированные в цикле Кребса, окислительном декарбоксилировании пирувата и перенесенные с помощью малатного челнока из цитоплазмы
Этапы катаболизма на примере ПАОГ :
Гликолиз, транспорт протонов в митохондрию (I этап),
Окислительное декарбоксилирование пирувата (II этап)
Цикл Кребса – III этап
Тканевое дыхание и сопряженное с ним окислительное фосфорилирование – IV этап (митохондриальный синтез АТФ)
II. В ходе второго этапа от пировиноградной кислоты отщепляется углекислый газ и два атома водорода. Отщепленные атомы водорода по дыхательной цепи передаются на кислород с одновременным синтезом АТФ. Из пирувата же образуется уксусная кислота. Она присоединяется к особому веществу, коферменту А.
Это вещество является переносчиком остатков кислот. Результатом этого процесса является образование вещества ацетилкофермент А. Это вещество обладает высокой химической активностью.
Итоговое уравнение второго этапа :
СЗН4ОЗ+ 1/2О2+ HSKoA + 3 АДФ + 3 НзРО4 - СНз- С ~ SKoA + СО2+ Н2О + 3АТФ
Пируват Кофермент А Ацетил-КоА
Ацетилкофермент А подвергается дальнейшему окислению в цикле трикарбоновых кислот (цикл Кребса) и превращается в СО2 и Н2О.
III. Это и есть третий этап . За счёт выделяющейся энергии на этом этапе также осуществляется синтез АТФ.
Цикл трикарбоновых кислот (ЦТК) - это завершающий этап катаболизма не только углеводов, но и всех остальных классов органических соединений. Это обусловлено тем, что при распаде углеводов, жиров и аминокислот образуется общий промежуточный продукт - уксусная кислота, связанная со своим переносчиком - коферменгом А - в форме ацетилкофермента А.
Цикл Кребса протекает в митохондриях с обязательным потреблением кислорода и требует функционирования тканевого дыхания.
Первой реакцией цикла является взаимодействие ацетилкофермента А со щавелево-уксусной кислотой(ЩУК) с образованием лимонной кислоты.
Лимонная кислота содержит три карбоксильные группы, т. е. является трикарбоновой кислотой, что обусловило название этого цикла.
Поэтому эти реакции и называют циклом лимонной кислоты. Образуя ряд промежуточных трикарбоновых кислот, лимонная кислота вновь превращается в щавелево-уксусную и цикл повторяется. Результатом этих реакций является образование отщепленного водорода, которые, пройдя по дыхательной цепи, образует с кислородом воду. Перенос каждой пары атомов водорода на кислород сопровождается синтезом трех молекул АТФ. Всего при окислении одной молекулы ацетилкофермента А синтезируется 12 молекул АТФ.
Итоговое уравнение цикла Кребса (третьего этапа):
СНз- С ~ SKoA + 2О2+ Н2О + 12АДФ + 12 Н3РО → НSKoA + 2 СО2 + Н2О + 12АТФ
Схематично цикл Кребса можно представить следующим образом:
В результате всех этих реакции образуется 36 молекул АТФ. В сумме гликолиз дает 38 молекул АТФ в пересчете на одну молекулу глюкозы.
Глюкоза + 6 О2 + 38 АДФ + 38 Н3 РО4 → 6СО2 + 6 Н2О +38 АТФ
Биологическая роль ЦТК
Цикл Кребса выполняет интеграционную, амфиболическую (т.е. катаболическую и анаболическую), энергетическую и водород-донорную роль.
1. Интеграционная роль состоит в том, что ЦТК представляет собой конечный общий путь окисления топливных молекул – углеводов, жирных кислот и аминокислот.
2. В ЦТК происходит окисление ацетил-КоА – это катаболическая роль.
3. Анаболическая роль цикла заключается в том, что он поставляет промежуточные продукты для биосинтетических процессов. Например, оксалоацетат используется для синтеза аспартата, a-кетоглутарат – для образования глутамата, сукцинил-КоА – для синтеза гема.
4. Одна молекула АТФ образуется в ЦТК на уровне субстратного фосфорилирования –это энергетическая роль.
5. Водород-донорная состоит в том, что ЦТК обеспечивает восстановленными коферментами НАДН (Н+) и ФАДН2дыхательную цепь, в которой происходит окисление водорода этих коферментов до воды, сопряженное с синтезом АТФ. При окислении одной молекулы ацетил-КоА в ЦТК образуются 3 НАДН(Н+) и 1 ФАДН2
IV этап. Тканевое дыхание и сопряженное с ним окислительное фосфорилирование (митохондриальный синтез АТФ)
Это перенос электронов от восстановленных нуклеотидов на кислород (через дыхательную цепь). Он сопровождается образованием конечного продукта - молекулы воды. Этот транспорт электронов сопряжен с синтезом АТФ в процессе окислительного фосфорилирования.

Окисление органических веществ в клетках, сопровождающееся потреблением кислорода и синтезом воды, называют тканевым дыханием , а цепь переноса электронов (ЦПЭ) – дыхательной цепью .
Особенности биологического окисления:
1.Протекает при температуре тела;
2.В присутствии Н2О;
3.Протекает постепенно через многочисленные стадии с участием ферментов-переносчиков, которые снижают энергию активации, происходит уменьшение свободной энергии, в результате чего энергия выделяется порциями. Поэтому окисление не сопровождается повышением температуры и не приводит к взрыву.
Электроны, поступающие в ЦПЭ, по мере их продвижения от одного переносчика к другому теряют свободную энергию. Значительная часть этой энергии запасается в АТФ, а часть рассеивается в виде тепла.
Перенос электронов от окисляемых субстратов к кислороду происходит в несколько этапов. В нем участвует большое количество промежуточных переносчиков, каждый из которых способен присоединять электроны от предыдущего переносчика и передавать следующему. Так возникает цепь окислительно-восстановительных реакций, в результате чего происходят восстановление О2 и синтез Н2О.
Транспорт электронов в дыхательной цепи сопряжён (связан) с образованием протонного градиента, необходимого для синтеза АТФ. Этот процесс называется окислительным фосфорилированием . Иными словами, окислительное фосфорилировние – это процесс, в котором энергия биологического окисления превращается в химическую энергию АТФ.
Функция дыхательной цепи – утилизация восстановленных дыхательных переносчиков, образующихся в реакциях метаболического окисления субстратов (главным образом в цикле трикарбоновых кислот). Каждая окислительная реакция в соответствии с величиной высвобождаемой энергии «обслуживается» соответствующим дыхательным переносчиком: НАДФ, НАД или ФАД. В дыхательной цепи происходит дискриминация протонов и электронов: в то время как протоны переносятся через мембрану, создавая ΔрН, электроны движутся по цепи переносчиков от убихинона к цитохромоксидазе, генерируя разность электрических потенциалов, необходимую для образования АТФ протонной АТФ-синтазой. Таким образом, тканевое дыхание «заряжает» митохондриальную мембрану, а окислительное фосфорилирование «разряжает» ее.
ДЫХАТЕЛЬНЫЙ КОНТРОЛЬ
Перенос электронов по ЦПЭ и синтез АТФ тесно сопряжены, т.е. могут происходить только одновременно и синхронно.
При увеличении расхода АТФ в клетке увеличивается количество АДФ и его поступление в митохондрии. Повышение концентрации АДФ (субстрата АТФ-синтазы) увеличивает скорость синтеза АТФ. Таким образом, скорость синтеза АТФ точно соответствует потребности клетки в энергии. Ускорение тканевого дыхания и окислительного фосфорилирования при повышении концентрации AДФ называется дыхательным контролем.
В реакциях ЦПЭ часть энергии не превращается в энергию макроэргических связей АТФ, а рассеивается в виде теплоты.
Разность электрических потенциалов на митохондриальной мембране, создаваемая дыхательной цепью, которая выступает в качестве молекулярного проводника электронов, является движущей силой для образования АТФ и других видов полезной биологической энергии. Эта концепция превращения энергии в живых клетках была выдвинута П. Митчеллом в 1960 г. для объяснения молекулярного механизма сопряжения транспорта электронов и образования АТФ в дыхательной цепи и быстро получила международное признание. За развитие исследований в области биоэнергетики П. Митчеллу в 1978 г. была присуждена Нобелевская премия. В 1997 г. П. Бойеру и Дж. Уокеру была присуждена Нобелевская премия за выяснение молекулярных механизмов действия главного фермента биоэнергетики -протонной АТФ-синтазы.
Расчет энергетического выхода ПАОГ по этапам:
Гликолиз – 2 АТФ (субстратное фосфорилирование)
Перенос протонов в митохондрию – 2 НАДН*Н+=6 АТФ
Окислительное декарбоксилирование 2 моль ПВК – 2 НАДН*Н+=6 АТФ
Цикл Кребса (с учетом ТД и ОФ) – 12*2=24 моль АТФ при сгорании 2 ацетильных остатков
ИТОГО : 38 моль АТФ при полном сгорании 1 моль глюкозы
Значение гликолиза:
1) осуществляет связь между дыхательными субстратами и циклом Кребса;
2) поставляет на нужды клетки две молекулы АТФ и две молекулы НАДH при окислении каждой молекулы глюкозы (в условиях аноксии гликолиз, по-видимому, служит основным источником АТФ в клетке);
3) производит интермедиаты для синтетических процессов в клетке (например, фосфоенолпируват, необходимый для образования фенольных соединений и лигнина);
4) в хлоропластах обеспечивает прямой путь для синтеза АТФ, независимый от поставок НАДФH; кроме того, через гликолиз в хлоропластах запасенный крахмал метаболизируется в триозы, которые затем экспортируются из хлоропласта.
КПД гликолиза составляет 40%.
5. Взаимопревращение гексоз
6. Глюконеогенез - образование углеводов из неуглеводных продуктов (пирувата, лактата, глицерина, аминокислот, липидов, белков и т. д.).
Похожая информация.
Глюконеогенез - это процесс синтеза глюкозы из веществ неуглеводной природы. У млекопитающих эту функцию выполняет в основном печень , в меньшей мере - почки и клетки слизистой кишечника . Главными субстратами глюконеогенеза являютсяпируват, лактат, глицерин, аминокислоты (рис.10).
Рисунок 10
Глюконеогенез обеспечивает потребности организма в глюкозе в тех случаях, когда диета содержит недостаточное количество углеводов (физическая нагрузка, голодание). Постоянное поступление глюкозы особенно необходимо для нервной системы и эритроцитов. При понижении концентрации глюкозы в крови ниже определенного критического уровня нарушается функционирование мозга; при тяжелой гипогликемии возникает коматозное состояние и может наступить летальный исход.
Запасов гликогена в организме достаточно для удовлетворения потребностей в глюкозе в период между приемами пищи. При углеводном или полном голодании, а также в условиях длительной физической работы концентрация глюкозы в крови поддерживается за счет глюконеогенеза. В этот процесс могут быть вовлечены вещества, которые способны превратиться в пируват или любой другой метаболит глюконеогенеза. На рисунке показаны пункты включения первичных субстратов в глюконеогенез:
Глюкоза необходима для жировой ткани как источник глицерола, входящего в состав глицеридов; она играет существенную роль в поддержании эффективных концентраций метаболитов цикла лимонной кислоты во многих тканях. Даже в условиях, когда большая часть потребностей организма в калориях обеспечивается за счет жира, всегда сохраняется определенная потребность в глюкозе. Кроме того, глюкоза служит единственным видом топлива для работы скелетной мышцы в анаэробных условиях. Она является предшественником молочного сахара (лактозы) в молочных железах и активно потребляется плодом в период развития. Механизм глюконеогенеза используется для удаления из крови продуктов тканевого метаболизма, например лактата, образующегося в мышцах и эритроцитах, глицерола, непрерывно образующегося в жировой ткани
Включение различных субстратов в глюконеогенез зависит от физиологического состояния организма. Лактат является продуктом анаэробного гликолиза в эритроцитах и работающих мышцах. Глицерин высвобождается при гидролизе жиров в жировой ткани в постабсорбтивный период или при физической нагрузке. Аминокислоты образуются в результате распада мышечных белков.
Семь реакций гликолиза легко обратимы и используются в глюконеогенезе. Но три киназные реакции необратимы и должны шунтироваться (рис. 12). Так, фруктозо-1,6-дифосфат и глюкозо-6-фосфат дефосфорилируются специфическими фосфатазами, а пируват фосфорилируется до образования фосфоенолпирувата посредством двух промежуточных стадий через оксалоацетат. Образование оксалоацетата катализируется пируваткарбоксилазой. Этот фермент содержит в качестве кофермента биотин. Оксалоацетат образуется в митохондриях, транспортируется в цитозоль и включается в глюконеогенез. Следует обратить внимание на то, что каждая из необратимых реакций гликолиза вместе с соответствующей ей необратимой реакцией глюконеогенеза составляют цикл, называемый субстратным:
Рисунок 12
Таких циклов существует три - соответственно трем необратимым реакциям. Эти циклы служат точками приложения регуляторных механизмов , в результате чего изменяется поток метаболитов либо по пути распада глюкозы, либо по пути ее синтеза.
Направление реакцийпервого субстратного цикла регулируется главным образом концентрацией глюкозы. При пищеварении концентрация глюкозы в крови повышается. Активность глюкокиназы в этих условиях максимальна. Вследствие этого ускоряется гликолитическая реакцияглюкоза ® глюкозо-6-фосфат. Кроме того, инсулин индуцирует синтез глюкокиназы и ускоряет тем самым фосфорилирование глюкозы. Поскольку глюкокиназа печени не ингибируется глюкозо-6-фосфатом (в отличие от гексокиназы мышц), то основная часть глюкозо-6-фосфата направляется по гликолитическому пути.
Превращение глюкозо-6-фосфата в глюкозу катализируется другой специфической фосфатазой-глюкозо-6-фосфатазой. Она присутствует в печени и почках, но отсутствует в мышцах и жировой ткани. Наличие этого фермента позволяет ткани поставлять глюкозу в кровь.
Распад гликогена с образованием глюкозо-1-фосфата осуществляется фосфорилазой. Синтез гликогена идет по совершенно другому пути, через образование уридиндифосфатглюкозы, и катализируетсягликогенсинтазой .
Второй субстратный цикл: превращение фруктозо-1,6-бисфосфата во фруктозо-6-фосфат, катализируется специфическим ферментомфруктозо-1,6-бисфосфатазой. Этот фермент имеется в печени и почках, он был также обнаружен в поперечнополосатых мышцах.
Направление реакцийвторого субстратного цикла зависит от активности фосфофруктокиназы и фосфатазы фруктозо-1,6-бисфосфата. Активность этих ферментов зависит от концентрации фруктозо-2,6-бисфосфата.
Фруктозо-2,6-бисфосфат образуется путем фосфорилирования фруктозо-6-фосфата при участии бифункционального фермента (БИФ), который катализирует также и обратную реакцию.
Киназная активность проявляется, когда бифункциональный фермент находится в дефосфорилированной форме (БИФ-ОН). Дефосфорилированная форма БИФ характерна для абсорбтивного периода, когда инсулин-глюкагоновый индекс высокий.
При низком инсулин-глюкагоновом индексе, характерном для периода длительного голодания, происходят фосфорилирование БИФ и проявление его фосфатазной активности, результатом чего являются снижение количества фруктозо-2,6-бисфосфата, замедление гликолиза и переключение на глюконеогенез.
Киназная и фосфатазная реакции катализируются разными активными центрами БИФ, но в каждом из двух состояний фермента - фосфорилиро-ванном и дефосфорилированном - один из активных центров ингибирован.
16.2.1. Глюконеогенез - биосинтез глюкозы из различных соединений неуглеводной природы. Биологическая роль глюконеогенеза заключается в поддержании постоянного уровня глюкозы в крови, что необходимо для нормального энергообеспечения тканей, для которых характерна непрерывная потребность в углеводах. Особенно это касается центральной нервной системы.
Роль глюконеогенеза возрастает при недостаточном поступлении углеводов с пищей. Так, в организме голодающего человека может синтезироваться до 200 г глюкозы в сутки. Глюконеогенез быстрее, чем другие метаболические процессы, реагирует на изменения диеты: введение с пищей большого количества белков и жиров активизирует процессы глюконеогенеза; избыток углеводов, наоборот, тормозит новообразование глюкозы.
Интенсивные физические нагрузки сопровождаются быстрым истощением запасов глюкозы в организме. В этом случае глюконеогенез является основным путём пополнения углеводных ресурсов, предупреждая развитие гипогликемии. Глюконеогенез в организме тесно связан также с процессами обезвреживания аммиака и поддержанием кислотно-основного баланса.
16.2.2. Основным местом биосинтеза глюкозы de novo является печень. Глюконеогенез протекает также в корковом слое почек. Принято считать, что вклад почек в глюконеогенез в физиологических условиях составляет около 10% глюкозы, синтезируемой в организме; при патологических состояниях эта доля может значительно возрастать. Незначительная активность ферментов глюконеогенеза обнаружена в слизистой тонкого кишечника.
16.2.3. Последовательность реакций глюконеогенеза представляет собой обращение соответствующих реакций гликолиза. Лишь три реакции гликолиза необратимы вследствие происходящих в ходе их значительных энергетических сдвигов:
а) фосфорилирование глюкозы; б) фосфорилирование фруктозо-6-фосфата; в) превращение фосфоенолпирувата в пируват.Обход этих энергетических барьеров обеспечивают ключевые ферменты глюконеогенеза.
Обратный переход пирувата в фосфоенолпируват требует участия двух ферментов. Первый из них - пируваткарбоксилаза - катализирует реакцию образования оксалоацетата (рисунок 16.4, реакция 1). Коферментом пируваткарбоксилазы является биотин (витамин Н). Реакция протекает в митохондриях. Роль её заключается также в пополнении фонда оксалоацетата для цикла Кребса.
Все последующие реакции глюконеогенеза протекают в цитоплазме . Мембрана митохондрий непроницаема для оксалоацетата, и он переносится в цитоплазму в виде других метаболитов: малата или аспартата. В цитоплазме указанные соединения вновь переходят в оксалоацетат. При участии фосфоенолпируваткарбоксикиназы из оксалоацетата образуется фосфоенолпируват (рисунок 16.4, реакция 2).
Фосфоенолпируват в результате обращения ряда реакций гликолиза переходит во фруктозо-1,6-дифосфат. Превращение фруктозо-1,6-дифосфата во фруктозо-6-фосфат катализируетсяфруктозодифосфатазой (рисунок 16.4, реакция 3).
Фруктозо-6-фосфат изомеризуется в глюкозо-6-фосфат. Заключительной реакцией глюконеогенеза является гидролиз глюкозо-6-фосфата при участии фермента глюкозо-6-фосфатазы (рисунок 16.4, реакция 4).
Рисунок 16.4. Обходные реакции глюконеогенеза.
16.2.4. Основными источниками глюкозы в глюконеогенезе являются лактат, аминокислоты, глицерол и метаболиты цикла Кребса.
Лактат - конечный продукт анаэробного окисления глюкозы. Может включаться в глюконеогенез после окисления до пирувата в лактатдегидрогеназной реакции (см. раздел «Гликолиз», рисунок 15.4, реакция 11). При продолжительной физической работе основным источником лактата является скелетная мускулатура, в клетках которой преобладают анаэробные процессы. Накопление молочной кислоты в мышцах ограничивает их работоспособность. Это связано с тем, что при повышении концентрации молочной кислоты в ткани снижается уровень рН (молочнокислый ацидоз). Изменение рН приводит к ингибированию ферментов важнейших метаболических путей. В утилизации образующейся молочной кислоты важное место принадлежитглюкозо-лактатному циклу Кори (рисунок 16.5).

Рисунок 16.5. Цикл Кори и глюкозо-аланиновый цикл (пояснения в тексте).
Глюкогенные аминокислоты , к которым относятся большинство белковых аминокислот. Ведущее место в глюконеогенезе среди аминокислот принадлежит аланину , который может превращаться в пируват путём трансаминирования. При голодании, физической работе и других состояниях в организме функционирует глюкозо-аланиновый цикл , подобный циклу Кори для лактата (рисунок 16.2). Существование цикла аланин - глюкоза препятствует отравлению организма, так как в мышцах нет ферментов, утилизирующих аммиак. В результате тренировки мощность этого цикла значительно возрастает.
Другие аминокислоты могут, подобно аланину, превращаться в пируват, а также в промежуточные продукты цикла Кребса (α-кетоглутарат, фумарат, сукцинил-КоА). Все эти метаболиты способны преобразовываться в оксалоацетат и включаться в глюконеогенез.
Глицерол - продукт гидролиза липидов в жировой ткани. Этот процесс значительно усиливается при голодании. В печени глицерол превращается в диоксиацетонфосфат - промежуточный продукт гликолиза и может быть использован в глюконеогенезе.
Жирные кислоты и ацетил-КоА не являются предшественниками глюкозы. Окисление этих соединений обеспечивает энергией процесс синтеза глюкозы.
16.2.5. Энергетический баланс. Путь синтеза глюкозы из пирувата (рисунок 16.6) содержит три реакции, сопровождающиеся потреблением энергии АТФ или ГТФ:
а) образование оксалоацетата из пирувата (затрачивается молекула АТФ); б) образование фосфоенолпирувата из оксалоацетата (затрачивается молекула ГТФ); в) обращение первого субстратного фосфорилирования - образование 1,3-дифосфоглицерата из 3-фосфоглицерата (затрачивается молекула АТФ).Каждая из этих реакций повторяется дважды, так как для образования 1 молекулы глюкозы (С6 ) используются 2 молекулы пирувата (С3 ). Поэтому энергетический баланс синтеза глюкозы из пирувата составляет - 6 молекул нуклеозидтрифосфатов (4 молекулы АТФ и 2 молекулы ГТФ). При использовании других предшественников энергетический баланс биосинтеза глюкозы отличается.

Рисунок 16.6. Энергетический баланс биосинтеза глюкозы из лактата.
16.2.6. Регуляция глюконеогенеза. Скорость глюконеогенеза определяется доступностью субстратов - предшественников глюкозы. Увеличение концентрации в крови любого из предшественников глюкозы приводит к стимуляции глюконеогенеза.
Некоторые метаболиты являются аллостерическими эффекторами ферментов глюконеогенеза. Например, ацетил-КоА в повышенных концентрациях аллостерически активирует пируваткарбоксилазу, катализирующую первую реакцию глюконеогенеза. Аденозинмонофосфат, наоборот, оказывает ингибирующее действие на фруктозодифосфатазу, а избыток глюкозы ингибирует глюкозо-6-фосфатазу.
Гормон поджелудочной железы глюкагон, гормоны надпочечников адреналин и кортизол повышают скорость биосинтеза глюкозы в организме, увеличивая активность ключевых ферментов глюконеогенеза либо увеличивая концентрацию этих ферментов в клетках. Гормон поджелудочной железы инсулин способствует снижению скорости глюконеогенеза в организме.
В клетках организма всегда существует потребность в глюкозе:
- для эритроцитов глюкоза является единственным источником энергии,
- нервная ткань потребляет около 120 г глюкозы в сутки и эта величина практически не зависит от интенсивности ее работы. Только в экстремальных ситуациях (длительное голодание) она способна получать энергию из неуглеводных источников (кетоновые тела),
- глюкоза играет весомую роль для поддержания необходимых концентраций метаболитов цикла трикарбоновых кислот (в первую очередь оксалоацетата ).
Таким образом, при определенных ситуациях – при низком содержании углеводов в пище, голодании, длительной физической работе, т.е. когда глюкоза крови расходуется и наступает гипогликемия , организм должен иметь возможность синтезировать глюкозу и нормализовать ее концентрацию в крови. Это достигается реакциями глюконеогенеза .
По определению, глюконеогенез – это синтез глюкозы из неуглеводных компонентов: лактата, пирувата, глицерола, кетокислот цикла Кребса и других кетокислот, из аминокислот.
Необходимость глюконеогенеза и его значение для организма демонстрируют два цикла – глюкозо-лактатный и глюкозо-аланиновый .
Глюкозо-лактатный цикл (цикл Кори)
Глюкозо-лактатный цикл – это циклический процесс, объединяющий реакции глюконеогенеза и реакции анаэробного гликолиза. Глюконеогенез происходит в печени, субстратом для синтеза глюкозы является лактат, поступающий в основном из эритроцитов или мышечной ткани .
В эритроцитах молочная кислота образуется непрерывно, так как для них анаэробный гликолиз является единственным способом образования энергии.
В скелетных мышцах высокое накопление молочной кислоты (лактата) является следствием гликолиза при очень интенсивной, субмаксимальной мощности, работе, при этом внутриклеточный рН снижается до 6,3-6,5. Но даже при работе низкой и средней интенсивности в скелетной мышце всегда образуется некоторое количество лактата.
Убрать молочную кислоту можно только одним способом – превратить ее в пировиноградную кислоту. Однако сама мышечная клетка ни при работе, ни во время отдыха не способна превратить лактат в пируват из-за особенностей изофермента лактатдегидрогеназы-5. Зато клеточная мембрана высоко проницаема для лактата и он движется по градиенту концентрации наружу. Поэтому во время и после нагрузки (при восстановлении) лактат легко удаляется из мышцы. Это происходит довольно быстро, всего через 0,5-1,5 часа в мышце лактата уже нет. Малая часть молочной кислоты выводится с мочой.
Большая часть лактата крови захватывается гепатоцитами, окисляется в пировиноградную кислоту и вступает на путь глюконеогенеза . Глюкоза, образованная в печени, используется самим гепатоцитом или возвращается обратно в мышцы, восстанавливая во время отдыха запасы гликогена. Также она может распределиться по другим органам.
Глюкозо-лактатный (выделен желтым) и глюкозо-аланиновый циклы
Глюкозо-аланиновый цикл
Целью глюкозо-аланинового цикла также является уборка пирувата, но кроме этого решается еще одна немаловажная задача – доставка аминного азота из мышцы в печень.
При мышечной работе и в покое в миоците распадаются белки и образуемые аминокислоты
Глюконеогенез – синтез глюкозы из неуглеводных продуктов. Такими продуктами или метаболитами являются в первую очередь молочная и пировиноградная кислоты, гликогенные аминокислоты, глицерол и ряд других соединений. Иными словами, предшественниками глюкозы в глюконеогенезе может быть пируват или любое соединение, превращающееся в процессе катаболизма в пируват или один из промежуточных продуктов цикла трикарбоновых кислот.


У позвоночных наиболее интенсивно глюконеогенез протекает в клетках печени и почек (в корковом веществе). Большинство стадий глюконеогенеза представляет собой обращение реакции гликолиза. Только 3 реакции гликолиза (гексокиназная, фосфофруктокиназная и пируваткиназная) необратимы, поэтому в процесс глюконеогенеза на 3 этапах используются другие ферменты.

Синтез фосфоенолпирувата осуществляется в несколько этапов: 1) Превращение пирувата в оксалоацетат. Пируват карбоксилируется пируваткарбоксилазой при участии АТФ: Пируваткарбоксилаза, которая катализирует эту реакцию, является аллостерическим митохондриальным ферментом. В качестве аллостерического активатора данного фермента необходим ацетил-КоА.




Фосфоенолпируват, образовавшийся из пирувата, в результате ряда обратимых реакций гликолиза превращается во фруктозо- 1,6-бисфосфат. Далее следует фосфофруктокиназная реакция, которая необратима. Глюконеогенез идет в обход этой реакции. Превращение фруктозо-1,6-бис-фосфата во фруктозо-6-фосфат катализируется специфической фосфатазой:



Регуляция глюконеогенеза. Роль аллостерического активатора пируваткарбоксилазы выполняет ацетил-КоА. В отсутствие ацетил-КоА фермент почти полностью лишен активности. Когда в клетке накапливается митохондриальный ацетил-КоА, биосинтез глюкозы из пирувата усиливается. Известно, что ацетил- КоА одновременно является отрицательным модулятором пируватдегидрогеназного комплекса. Накопление ацетил-КоА замедляет окислительное декарбоксилирование пирувата, что также способствует активации глюконеогенеза.

Другой важный момент в регуляции глюконеогенеза – реакция, катализируемая фруктозо-1,6-бисфосфатазой – ферментом, который ингибируется АМФ. Противоположное действие АМФ оказывает на фосфофрукто киназу, т. е. для этого фермента он является аллостерическим активатором. При низкой концентрации АМФ и высоком уровне АТФ происходит стимуляция глюконеогенеза. Напротив, когда величина отношения АТФ/АМФ мала, в клетке наблюдается расщепление глюкозы. Глюконеогенез и гликолиз регулируются реципрокно, так что, если активность одного из путей относительно понижается, то активность другого пути повышается.


Фруктозо-2,6-бисфосфат это метаболит, образующийся из фруктозо-6-фосфата и выполняющий только регуляторные функции. Образование фруктозо-2,6-бисфосфата путем фосфорилирования фруктозо-6-фосфата катализирует бифункциональный фермент (БИФ), который катализирует также и обратную реакцию. В реакции фосфорилирования фруктозо-6-фосфата с использованием АТФ БИФ проявляет киназную активность, а при дефосфорилировании образованного фруктозо-2,6-бисфосфата фосфатазную. Это обстоятельство и определило название фермента бифункциональный.

Киназная активность БИФ проявляется, когда фермент находится в дефосфорилированной форме (БИФ-ОН). Дефосфорилированная форма БИФ характерна для периода, когда инсулин/глюкагоновый индекс высокий. В этот период количество фруктозо-2,6-бисфосфата увеличивается. При низком инсулин/глюкагоновом индексе, характерном для периода длительного голодания, происходит фосфорилирование БИФ, и он функционирует как фосфатаза. Результатом является снижение количества фруктозо-2,6- бисфосфата


Глюконеогенез может регулироваться и непрямым путем. Фермент гликолиза пируваткиназа существует в 2 формах – L и М. Форма L (от англ. liver – печень) преобладает в тканях, способных к глюконеогенезу. Эта форма ингибируется избытком АТФ и некоторыми аминокислотами, в частности аланином. М-форма (от англ. muscle – мышцы) такой регуляции не подвержена. В условиях достаточного обеспечения клетки энергией происходит ингибирование L-формы пируваткиназы. Как следствие ингибирования замедляется гликолиз и создаются условия, благоприятствующие глюконеогенезу.


Лактат, образовавшийся в интенсивно работающих мышцах или в клетках с преобладающим анаэробным способом катаболизма глюкозы, поступает в кровь, а затем в печень. В печени отношение NАDН/NАD+ ниже, чем в сокращающейся мышце, поэтому лактатдегидрогеназная реакция протекает в обратном направлении, т.е. в сторону образования пирувата из лактата. Далее пируват включается в глюконеогенез, а образовавшаяся глюкоза поступает в кровь и поглощается скелетными мышцами. Эта последовательность событий называется глюкозо-лактатным циклом, или циклом Кори


Ацетил-КоА + НАДН + Н+ + СO2 Окисление пирувата до ацетил-КоА происходит при участии мультиферментной системы, получившую название пируватдегидрогеназный комплекс Образовавшийся в процессе окислительного декарбоксилирования" title="Пируват + НАД+ + HS-KoA –> Ацетил-КоА + НАДН + Н+ + СO2 Окисление пирувата до ацетил-КоА происходит при участии мультиферментной системы, получившую название пируватдегидрогеназный комплекс Образовавшийся в процессе окислительного декарбоксилирования" class="link_thumb"> 22 Пируват + НАД+ + HS-KoA –> Ацетил-КоА + НАДН + Н+ + СO2 Окисление пирувата до ацетил-КоА происходит при участии мультиферментной системы, получившую название пируватдегидрогеназный комплекс Образовавшийся в процессе окислительного декарбоксилирования ацетил-КоА подвергается дальнейшему окислению с образованием СО2 и Н2О. Полное окисление ацетил-КоА происходит в цикле трикарбоновых кислот (цикл Кребса). Этот процесс, так же как окислительное декарбоксилирование пирувата, происходит в митохондриях клеток Ацетил-КоА + НАДН + Н+ + СO2 Окисление пирувата до ацетил-КоА происходит при участии мультиферментной системы, получившую название пируватдегидрогеназный комплекс Образовавшийся в процессе окислительного декарбоксилирования"> Ацетил-КоА + НАДН + Н+ + СO2 Окисление пирувата до ацетил-КоА происходит при участии мультиферментной системы, получившую название пируватдегидрогеназный комплекс Образовавшийся в процессе окислительного декарбоксилирования ацетил-КоА подвергается дальнейшему окислению с образованием СО2 и Н2О. Полное окисление ацетил-КоА происходит в цикле трикарбоновых кислот (цикл Кребса). Этот процесс, так же как окислительное декарбоксилирование пирувата, происходит в митохондриях клеток"> Ацетил-КоА + НАДН + Н+ + СO2 Окисление пирувата до ацетил-КоА происходит при участии мультиферментной системы, получившую название пируватдегидрогеназный комплекс Образовавшийся в процессе окислительного декарбоксилирования" title="Пируват + НАД+ + HS-KoA –> Ацетил-КоА + НАДН + Н+ + СO2 Окисление пирувата до ацетил-КоА происходит при участии мультиферментной системы, получившую название пируватдегидрогеназный комплекс Образовавшийся в процессе окислительного декарбоксилирования"> title="Пируват + НАД+ + HS-KoA –> Ацетил-КоА + НАДН + Н+ + СO2 Окисление пирувата до ацетил-КоА происходит при участии мультиферментной системы, получившую название пируватдегидрогеназный комплекс Образовавшийся в процессе окислительного декарбоксилирования">
Е1 - пируватдегидрогеназа; Е2 - дигидролипоилацетилтрансфсраза; Е3 - дигидролипоилдегидрогеназа Коферменты: ТПФ, амид липоевой кислоты, коэнзим А, ФАД, НАД стадии процесса


Цикл Кребса – общий конечный путь окисления ацетильных групп (в виде ацетил-КоА), в которые превращается в процессе катаболизма большая часть органических молекул, играющих роль клеточного топлива: углеводов, жирных кислот и аминокислот. Цикл происходит в матриксе митохондрий и состоит из восьми последовательных реакций


В результате второй реакции образовавшаяся лимонная кислота подвергается дегидратированию с образованием цис- аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту (изоцитрат). Катализирует эти обратимые реакции гидратации–дегидратации фермент аконитатгидратаза (аконитаза).

Третья реакция лимитирует скорость цикла Кребса. Изолимонная кислота дегидрируется в присутствии НАД- зависимой изоцитратдегидрогеназы: НАД-зависимая изоцитратдегидрогеназа является аллостерическим ферментом, которому в качестве специфического активатора необходим АДФ. Кроме того, фермент для проявления своей активности нуждается в ионах Mg2+ или Мn2+

Во время четвертой реакции происходит окислительное декарбоксилирование α-кетоглутаровой кислоты с образованием высокоэнергетического соединения сукцинил-КоА. Механизм этой реакции сходен с таковым реакции окислительного декарбоксилирования пирувата до ацетил-КоА. α-Кетоглутаратдегидрогеназный комплекс напоминает по своей структуре пируватдегидрогеназный комплекс. Как в одном, так и в другом случае в реакции принимают участие 5 коферментов: ТПФ, амид липоевой кислоты, HS-KoA, ФАД и НАД+:

Пятая реакция катализируется ферментом сукцинил-КоА- синтетазой. В ходе этой реакции сукцинил-КоА при участии ГТФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической фосфатной связи ГТФ за счет высокоэргической тиоэфирной связи сукцинил-КоА: АТФ Субстратное фофорилирование

В результате шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой, в молекуле которой с белком прочно (ковалентно) связан кофермент ФАД. В свою очередь сукцинатдегидрогеназа прочно связана с внутренней митохондриальной мембраной:

Седьмая реакция осуществляется под влиянием фермента фумаратгидратазы (фумаразы). Фумаровая кислота гидратируется, продуктом реакции является яблочная кислота (малат). Следует отметить, что фумаратгидратаза обладает стереоспецифичностью: в ходе реакции образуется L-яблочная кислота:


Одна молекула НАДН (3 молекулы АТФ) образуется при окислительном декарбоксилировании пирувата в ацетил-КоА. При расщеплении одной молекулы глюкозы образуется 2 молекулы пирувата, а при окислении их до 2 молекул ацетил-КоА и последующих 2 оборотов цикла трикарбоновых кислот синтезируется 30 молекул АТФ (следовательно, окисление молекулы пирувата до СО2 и Н2О дает 15 молекул АТФ). К этому количеству надо добавить 2 молекулы АТФ, образующиеся при аэробном гликолизе, и 6 молекул АТФ, синтезирующихся за счет окисления 2 молекул внемитохондриального НАДН, которые образуются при окислении 2 молекул глицеральдегид-3-фосфата в дегидрогеназной реакции гликолиза. Следовательно, при расщеплении в тканях одной молекулы глюкозы синтезируется 38 молекул АТФ. Несомненно, что в энергетическом отношении полное расщепление глюкозы является более эффективным процессом, чем анаэробный гликолиз.

Молекулы внемитохондриального НАДН не способны проникать через мембрану внутрь митохондрий. Однако отдаваемые ими электроны могут включаться в митохондриальную цепь биологического окисления с помощью так называемого глицеролфосфатного челночного механизма При этом в результате полного окисления одной молекулы глюкозы может образоваться 36 молекул АТФ С помощью данного челночного механизма лишь в скелетных мышцах и мозге осуществляется перенос восстановленных эквивалентов от цитозольного НАДН + Н+ в митохондрии.


В клетках печени, почек и сердца действует более сложная малат-аспартатная челночная система. Действие такого челночного механизма становится возможным благодаря присутствию малатдегидрогеназы и аспартатаминотрансферазы как в цитозоле, так и в митохондриях. Если функционирует малат-аспартатный механизм, то в результате полного окисления одной молекулы глюкозы может образоваться не 36, а 38 молекул АТФ



Открытие пути прямого окисления углеводов, или, как его называют, пентозофосфатного цикла, принадлежит О. Варбургу, Ф. Липману, Ф. Дикенсу и В.А. Энгельгарду У млекопитающих активность пентозофосфатного цикла относительно высока в печени, надпочечниках, эмбриональной ткани и молочной железе в период лактации. Значение этого пути в обмене веществ велико. Он поставляет восстановленный НАДФН, необходимый для биосинтеза жирных кислот, холестерина и т.д. За счет пентозофосфатного цикла примерно на 50% покрывается потребность организма в НАДФН Образовавшийся НАДФН используется в цитозоле на восстановительные синтезы и не участвует в окислительном фосфорилировании, протекающем в митохондриях. Пентозофосфатный цикл поставляет пентозофосфаты для синтеза нуклеиновых кислот и многих коферментов.

Пентозофосфатный цикл начинается с окисления глюкозо-6- фосфата и последующего окислительного декарбоксилирования продукта (в результате от гексозофосфата отщепляется первый атом углерода). Это первая, так называемая окислительная, стадия пентозофосфатного цикла.


Первая реакция – дегидрирование глюкозо-6-фосфата при участии фермента глюкозо-6-фосфатдегидрогеназы и кофермента НАДФ+. Образовавшийся в ходе реакции 6-фосфоглюконо-δ-лактон – соединение нестабильное и с большой скоростью гидролизуется либо спонтанно, либо с помощью фермента 6-фосфоглюконолактоназы с образованием 6-фосфоглюконовой кислоты (6-фосфоглюконат) и НАДФН:

Во второй – окислительной – реакции, катализируемой 6-фосфоглюконатдегидрогеназой (декарбоксилирующей), 6- фосфоглюконат дегидрируется и декарбоксилируется. В результате образуется фосфорилированная кетопентоза – D-рибулозо-5-фосфат и еще 1 молекула НАДФН:

Под действием соответствующей эпимеразы из рибулозо-5- фосфата может образоваться другая фосфопентоза – ксилулозо-5- фосфат. Кроме того, рибулозо-5-фосфат под влиянием особой изомеразы легко превращается в рибозо-5-фосфат. Между этими формами пентозофосфатов устанавливается состояние подвижного равновесия:

Неокислительный этап (стадия) пентозофосфатного цикла. Реакции этого этапа не связаны с использованием кислорода и протекают в анаэробных условиях. При этом образуются вещества, характерные для первой стадии гликолиза (фруктозо- 6-фосфат, фруктозо-1,6-бисфосфат, фосфотриозы), а другие – специфические для пентозофосфатного пути (седогептулозо-7- фосфат, пентозо-5-фосфаты, эритрозо-4-фосфат).

Основными реакциями неокислительной стадии пентозофосфатного цикла являются транскетолазная и трансальдолазная. Эти реакции катализируют превращение изомерных пентозо-5-фосфатов. Коферментом в транскетолазной реакции служит ТПФ, играющий роль промежуточного переносчика гликольальдегидной группы от ксилулозо-5-фосфата к рибозо-5-фосфату. В результате образуется семиуглеродный моносахарид седогептулозо-7-фосфат и глицеральдегид-3-фосфат:




Синдром Вернике-Косакова (нервно-псих. заболевание) связан со значительным снижением (в 10 раз) способности транскетолазы связывать кофермент ТПФ. Дефект гена глюкозо-6- фосфатдегидрогеназы в эритроцитах сопровождается гемолитической анемией. Причина – недостаток НАДФН и, как следствие, недостаток восстановленного глутатиона (GSH), что приводит к росту образования активных форм кислорода и гемолизу эритроцитов