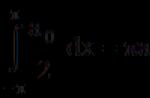Он опирался на труды Роберта Бойле и Антуана Лавузье. Первый ученый ратовал за поиск неразложимых химических элементов. 15 из таковых Бойле перечислил еще в 1668-ом году.
Лавузье прибавил к ним еще 13, но спустя век. Поиски растянулись, поскольку не было стройной теории связи между элементами. Наконец, в «игру» вступил Дмитрий Менделеев. Он решил, что есть связь между атомной массой веществ и их местом в системе.
Эта теория позволила ученому открыть десятки элементов, не обнаруживая их на практике, а природе. Это было возложено на плечи потомков. Но, сейчас не о них. Посвятим статью великому русскому ученому и его таблице.
История создания таблицы Менделеева
Таблица Менделеева началась с книги «Соотношение свойств с атомным весом элементов». Труд выпущен в 1870-ых. Тогда же русский ученый выступил перед химическим обществом страны и разослал первый вариант таблицы коллегам из-за рубежа.
До Менделеева разными учеными были открыты 63 элемента. Наш соотечественник начал со сравнения их свойств. В первую очередь, работал с калием и хлором. Потом, взялся за группу металлов щелочной группы.
Химик обзавелся специальным столом и карточками элементов, чтобы раскладывать их, как пасьянс, ища нужные совпадения и комбинации. В итоге, пришло прозрение: — свойства компонентов зависят от массы их атомов. Так, элементы таблицы Менделеева выстроились в ряды.
Находкой маэстро химии стало решение оставить в этих рядах пустоты. Периодичность перепада между атомными массами заставила ученого предположить, что человечеству известны еще не все элементы. Промежутки в весе между некоторыми «соседями» были слишком велики.

Поэтому, периодическая таблица Менделеева стала похожа на шахматное поле, с обилием «белых» клеток. Время показало, что они, действительно, ждали своих «постояльцев». Ими, к примеру, стали инертные газы. Гелий, неон, аргон, криптон, радиоакт и ксенон открыты лишь в 30-ых годах 20-го века.
Теперь о мифах. Распространено мнение, что химическая таблица Менделеева явилась ему во сне. Это происки университетских педагогов, точнее, одного из них – Александра Иностранцева. Это русский геолог, читавший лекции в Петербургском университете горного дела.
Иностранцев был знаком с Менделеевым, бывал у него в гостях. Однажды, изможденный поисками Дмитрий заснул прямо при Александе. Тот дождался, пока химик проснется и увидел, как Менделеев хватается за листок и записывает окончательный вариант таблицы.
По сути, ученый просто не успел сделать это до того, как его захватил Морфей. Однако, Иностранцеву хотелось позабавить своих студентов. На основе виденного геолог придумал байку, которую благодарные слушатели быстро распространили в массы.
Особенности таблицы Менделеева
С момента первой версии 1969-го года порядковая таблица Менделеева не раз дорабатывалась. Так, с открытием в 1930-ых благородных газов удалось вывести новую зависимость элементов, — от их порядковых номеров, а не массы, как заявлял автор системы.
Понятие «атомный вес» заменили на «атомный номер». Удалось изучить число протонов в ядрах атомов. Эта цифра и есть порядковый номер элемента.
Ученые 20-го века изучили и электронное строение атомов. Оно тоже влияет на периодичность элементов и отражено в поздних редакциях таблицы Менделеева. Фото списка демонстрирует, что вещества в нем расставлены по мере роста атомного веса.
Первооснову менять не стали. Масса увеличивается слева направо. При этом, таблица не едина, а поделена на 7 периоды. Отсюда и название списка. Период – горизонтальный ряд. Его начало – типичные металлы, конец – элементы с неметаллическими свойствами. Убывание постепенное.

Есть большие и малые периоды. Первые находятся в начале таблицы, их 3. Открывает список период из 2-х элементов. Следом идут две колонки, в которых по 8 наименований. Оставшиеся 4 периода большие. Наиболее протяжен 6-ой, в нем 32 элемента. В 4-ом и 5-ом их по 18, а в 7-ом – 24.
Можно сосчитать, сколько элементов в таблице Менделеева. Всего 112 наименований. Именно наименований. Клеток же 118, а есть вариации списка и со 126-ю полями. Все еще остаются пустые клетки для неоткрытых элементов, не имеющих имен.
Не все периоды умещаются в одну строку. Большие периоды состоят из 2-х рядов. Количество металлов в них перевешивает. Поэтому, им полностью посвящены нижние строки. Постепенное убывание от металлов к инертным веществам соблюдается в верхних рядах.
Картинки таблицы Менделеева поделены и вертикально. Это группы в таблице Менделеева , их 8. Вертикально скомпонованы элементы, схожие по химическим свойствам. Они поделены на главную и побочную подгруппы. Последние начинаются только с 4-го периода. В главные подгруппы входят и элементы малых периодов.
Суть таблицы Менделеева
Названия элементов в таблице Менделеева – это 112 позиций. Суть их компоновки в единый список – систематизация первоэлементов. Над этим начали биться еще в античные времена.
Одним из первых понять, из чего составлено все сущее попытался Аристотель. Он взял за основу свойства веществ – холод и тепло. Эмпидокл выделил 4-ре первоосновы по стихиям: воду, землю, огонь и воздух.
Металлы в таблице Менделеева , как и другие элементы, — те самые первоосновы, но с современной точки зрения. Российскому химику удалось открыть большинство составляющих нашего мира и предположить существование еще неизвестных первоэлементов.

Получается, что произношение таблицы Менделеева – озвучивание некой модели нашей реальности, раскладывание ее на составляющие. Однако, выучить их не так-то просто. Попробуем облегчить задачу, описав пару эффективных методов.
Как выучить таблицу Менделеева
Начнем с современного метода. Компьютерщиками разработан ряд флеш-игр, помогающих запомнить список Менделеева. Участникам проекта предлагают находить элементы по разным опциям, например, названию, атомной массе, буквенному обозначению.
Игрок имеет право выбрать поле деятельности – лишь часть таблицы, или ее всю. В нашей воле, так же, исключить имена элементов, другие параметры. Это усложняет поиск. Для продвинутых предусмотрен и таймер, то есть тренировка ведется на скорость.
Игровые условия делают изучение номеров элементов в таблице Менднлеева не нудным, а занятным. Просыпается азарт, и систематизировать знания в голове становится проще. Те же, кто не приемлет компьютерных флеш-проектов, предлагают более традиционный способ заучивания списка.
Его делят на 8 групп, или 18 (в соответствии с редакцией 1989-го года). Для удобства запоминания, лучше создать несколько отдельных таблиц, а не работать по цельному варианту. Помогают и зрительные образы, подобранные к каждому из элементов. Опираться следует на собственные ассоциации.
Так, железо в мозгу может соотноситься, к примеру, с гвоздем, а ртуть – с градусником. Название элемента незнакомо? Пользуемся методом наводящих ассоциаций. , например, составим из начал слов «ириска» и «динамик».
Характеристика таблицы Менделеева не учиться в один присест. Рекомендованы занятия по 10-20 минут в день. Начинать рекомендована с запоминания лишь основных характеристик: названия элемента, его обозначения, атомной массы и порядкового номера.
Школьники предпочитают вешать таблицу Менделеева над рабочим столом, или на стене, на которую часто смотрят. Метод хорош для людей с преобладанием зрительной памяти. Данные из списка невольно запоминаются даже без зубрежки.
Это учитывают и педагоги. Как правило, они не заставляют заучивать список, разрешают смотреть в него даже на контрольных. Постоянное заглядывание в таблицу равнозначно эффекту распечатки на стене, или написанию шпаргалок до экзаменов.
Приступая к изучению, вспомним, что и Менделеев не сразу запомнил свой список. Однажды, когда ученого спросили, как он открыл таблицу, последовал ответ: — «Я над ней, может, 20 лет думал, а вы считаете: сидел и, вдруг, готово». Периодическая система – кропотливый труд, который не осилить в сжатые сроки.

Наука не терпит спешки, ведь она приводит к заблуждениям и досадным ошибкам. Так, одновременно с Менделеевым таблицу составил и Лотар Мейер. Однако, немец немного недоработал список и не был убедителен при доказательстве своей точки зрения. Поэтому, общественность признала труд русского ученого, а не его коллеги-химика из Германии.
ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Построение периодической таблицы химических элементов Менделеева отвечает характерным периодам теории чисел и ортогональных базисов. Дополнение матриц Адамара матрицами четных и нечетных порядков создает структурный базис вложенных матричных элементов: матриц первого (Odin), второго (Euler), третьего (Mersenne), четвертого (Hadamard) и пятого (Fermat) порядков.
Несложно заметить, что порядкам 4k матриц Адамара соответствуют инертные элементы с атомной массой, кратной четырем: гелий 4, неон 20, аргон 40 (39.948) и т.п., но также и основы жизни и цифровой техники: углерод 12, кислород 16, кремний 28, германий 72.
Такое впечатление, что с матрицами Мерсенна порядков 4k –1, напротив, связано все активное, ядовитое, разрушительное и разъедающее. Но это также радиоактивные элементы – источники энергии, и свинец 207 (конечный продукт, ядовитые соли). Фтор, это, конечно, 19. Порядкам матриц Мерсенна отвечает последовательность радиоактивных элементов, называемая рядом актиния: уран 235, плутоний 239 (изотоп, который является более мощным источником атомной энергии, чем уран) и т.п. Это также щелочные металлы литий 7, натрий 23 и калий 39.

Галлий – атомный вес 68
Порядкам 4k –2 матриц Эйлера (сдвоенный Мерсенн) соответствует азот 14 (основа атмосферы). Поваренная соль образована двумя "мерсенноподобными" атомами натрия 23 и хлора 35, вместе это сочетание характерно, как раз, для матриц Эйлера. Более массивный хлор с весом 35.4 немногим не добирает до адамаровой размерности 36. Кристаллы поваренной соли: куб (! т.е. характер смирный, адамаров) и октаэдр (более вызывающий, это несомненный Эйлер).
В атомной физике переход железо 56 – никель 59, это рубеж между элементами, дающими энергию при синтезе более крупного ядра (водородная бомба) и распаде (урановая). Порядок 58 знаменит тем, что для него нет не только аналогов матриц Адамара в виде матриц Белевича с нулями на диагонали, для него нет и многих взвешенных матриц – ближайшая ортогональная W(58,53) имеет 5 нулей в каждом столбце и строке (глубокий разрыв).
В ряду, соответствующем матрицам Ферма и их замещениям порядков 4k +1, стоит волею судьбы фермий 257. Ничего не скажешь, точное попадание. Здесь же золото 197. Медь 64 (63.547) и серебро 108 (107.868), символы электроники, недотягивают, как видно, до золота и соответствуют более скромным матрицам Адамара. Медь, с ее недалеко ушедшим от 63 атомным весом, химически активна – ее зеленые окислы хорошо известны.

Кристаллы бора под сильным увеличением
С золотым сечением связан бор – атомная масса среди всех прочих элементов наиболее близка к 10 (точнее 10.8, близость атомного веса к нечетным числам тоже сказывается). Бор – достаточно сложный элемент. Бор играет запутанную роль в истории самой жизни. Строение каркаса в его структурах гораздо сложнее, чем в алмазе. Уникальный тип химической связи, которая позволяет бору поглощать любую примесь, очень плохо изучен, хотя за исследования, связанные с ним, большое количество ученых уже получили Нобелевские премии. Форма кристалла бора – икосаэдр, пять треугольников образуют вершину.
Загадка Платины. Пятый элемент, это, без сомнения, благородные металлы, такие, как золото. Надстройка над адамаровой размерностью 4k , на 1 большие.

Стабильный изотоп уран 238
Вспомним, все же, что числа Ферма встречаются редко (ближайшее – 257). Кристаллы самородного золота имеют форму, близкую к кубу, но и пентаграмма просверкивает. Его ближайший сосед, платина, благородный металл, отстоит от золота 197 по атомному весу меньше, чем на 4. Платина имеет атомный вес не 193, а несколько повышенный, 194 (порядок матриц Эйлера). Мелочь, но это переносит ее в стан несколько более агрессивных элементов. Стоит вспомнить, в связи, что при ее инертности (растворяется, разве, в царской водке), платину используют как активный катализатор химических процессов.
Губчатая платина при комнатной температуре воспламеняет водород. Характер у платины вовсе не мирный, смирнее себя ведет иридий 192 (смесь изотопов 191 и 193). Это, скорее, медь, но с весом и характером золота.
Между неоном 20 и натрием 23 нет элемента с атомным весом 22. Конечно, атомные веса – интегральная характеристика. Но среди изотопов, в свою очередь, тоже наблюдается любопытная корреляция свойств со свойствами чисел и соответствующих им матриц ортогональных базисов. В качестве ядерного топлива наибольшее применение имеет изотоп уран 235 (порядок матриц Мерсенна), в котором возможна самоподдерживающаяся цепная ядерная реакция. В природе этот элемент распространен стабильной форме уран 238 (порядок матриц Эйлера). Элемент с атомным весом 13 отсутствует. Что касается хаоса, то ограниченное количество устойчивых элементов таблицы Менделеева и сложность нахождения уровневых матриц высоких порядков ввиду замеченного у матриц тринадцатого порядка барьера коррелируют.

Изотопы химических элементов, островок стабильности
Если таблица Менделеева кажется вам сложной для понимания, вы не одиноки! Хотя бывает непросто понять ее принципы, умение работать с ней поможет при изучении естественных наук. Для начала изучите структуру таблицы и то, какую информацию можно узнать из нее о каждом химическом элементе. Затем можно приступить к изучению свойств каждого элемента. И наконец, с помощью таблицы Менделеева можно определить число нейтронов в атоме того или иного химического элемента.
Шаги
Часть 1
Структура таблицы- Например, первая строка таблицы содержит водород, который имеет атомный номер 1, и гелий с атомным номером 2. Однако они расположены на противоположных краях, так как принадлежат к разным группам.
-
Узнайте о группах, которые включают в себя элементы со схожими физическими и химическими свойствами. Элементы каждой группы располагаются в соответствующей вертикальной колонке. Как правило, они обозначаются одним цветом, что помогает определить элементы со схожими физическими и химическими свойствами и предсказать их поведение. Все элементы той или иной группы имеют одинаковое число электронов на внешней оболочке.
- Водород можно отнести как к группе щелочных металлов, так и к группе галогенов. В некоторых таблицах его указывают в обеих группах.
- В большинстве случаев группы пронумерованы от 1 до 18, и номера ставятся вверху или внизу таблицы. Номера могут быть указаны римскими (например, IA) или арабскими (например,1A или 1) цифрами.
- При движении вдоль колонки сверху вниз говорят, что вы «просматриваете группу».
-
Узнайте, почему в таблице присутствуют пустые ячейки. Элементы упорядочены не только в соответствии с их атомным номером, но и по группам (элементы одной группы обладают схожими физическими и химическими свойствами). Благодаря этому можно легче понять, как ведет себя тот или иной элемент. Однако с ростом атомного номера не всегда находятся элементы, которые попадают в соответствующую группу, поэтому в таблице встречаются пустые ячейки.
- Например, первые 3 строки имеют пустые ячейки, поскольку переходные металлы встречаются лишь с атомного номера 21.
- Элементы с атомными номерами с 57 по 102 относятся к редкоземельным элементам, и обычно их выносят в отдельную подгруппу в нижнем правом углу таблицы.
-
Каждая строка таблицы представляет собой период. Все элементы одного периода имеют одинаковое число атомных орбиталей, на которых расположены электроны в атомах. Количество орбиталей соответствует номеру периода. Таблица содержит 7 строк, то есть 7 периодов.
- Например, атомы элементов первого периода имеют одну орбиталь, а атомы элементов седьмого периода - 7 орбиталей.
- Как правило, периоды обозначаются цифрами от 1 до 7 слева таблицы.
- При движении вдоль строки слева направо говорят, что вы «просматриваете период».
-
Научитесь различать металлы, металлоиды и неметаллы. Вы лучше будете понимать свойства того или иного элемента, если сможете определить, к какому типу он относится. Для удобства в большинстве таблиц металлы, металлоиды и неметаллы обозначаются разными цветами. Металлы находятся в левой, а неметаллы - в правой части таблицы. Металлоиды расположены между ними.
Часть 2
Обозначения элементов-
Каждый элемент обозначается одной или двумя латинскими буквами. Как правило, символ элемента приведен крупными буквами в центре соответствующей ячейки. Символ представляет собой сокращенное название элемента, которое совпадает в большинстве языков. При проведении экспериментов и работе с химическими уравнениями обычно используются символы элементов, поэтому полезно помнить их.
- Обычно символы элементов являются сокращением их латинского названия, хотя для некоторых, особенно недавно открытых элементов, они получены из общепринятого названия. К примеру, гелий обозначается символом He, что близко к общепринятому названию в большинстве языков. В то же время железо обозначается как Fe, что является сокращением его латинского названия.
-
Обратите внимание на полное название элемента, если оно приведено в таблице. Это «имя» элемента используется в обычных текстах. Например, «гелий» и «углерод» являются названиями элементов. Обычно, хотя и не всегда, полные названия элементов указываются под их химическим символом.
- Иногда в таблице не указываются названия элементов и приводятся лишь их химические символы.
-
Найдите атомный номер. Обычно атомный номер элемента расположен вверху соответствующей ячейки, посередине или в углу. Он может также находиться под символом или названием элемента. Элементы имеют атомные номера от 1 до 118.
- Атомный номер всегда является целым числом.
-
Помните о том, что атомный номер соответствует числу протонов в атоме. Все атомы того или иного элемента содержат одинаковое количество протонов. В отличие от электронов, количество протонов в атомах элемента остается постоянным. В противном случае получился бы другой химический элемент!
-
Таблица Менделеева, или периодическая система химических элементов, начинается в левом верхнем углу и заканчивается в конце последней строки таблицы (в нижнем правом углу). Элементы в таблице расположены слева направо в порядке возрастания их атомного номера. Атомный номер показывает, сколько протонов содержится в одном атоме. Кроме того, с увеличением атомного номера возрастает и атомная масса. Таким образом, по расположению того или иного элемента в таблице Менделеева можно определить его атомную массу.
Как видно, каждый следующий элемент содержит на один протон больше, чем предшествующий ему элемент. Это очевидно, если посмотреть на атомные номера. Атомные номера возрастают на один при движении слева направо. Поскольку элементы расположены по группам, некоторые ячейки таблицы остаются пустыми.
115 элемент таблицы Менделеева - московий (moscovium) - сверхтяжелый синтетический элемент с символом Mc и атомным номером 115. Он был впервые получен в 2003 году совместной командой российских и американских ученых в Объединенном институте ядерных исследований (ОИЯИ) в Дубне, Россия. В декабре 2015 года признан одним из четырех новых элементов Объединенной рабочей группой международных научных организаций IUPAC/IUPAP. 28 ноября 2016 года он был официально назван в честь Московского региона, в котором находится ОИЯИ.
Характеристика
115 элемент таблицы Менделеева является чрезвычайно радиоактивным веществом: его наиболее стабильный известный изотоп, moscovium-290 имеет период полураспада всего 0,8 секунды. Ученые относят московий к непереходным металлам, по ряду характеристик схожим с висмутом. В периодической таблице относится к трансактинидным элементам p-блока 7-го периода и помещен в группу 15 как самый тяжелый пниктоген (элемент подгруппы азота), хотя и не подтверждено, что он ведет себя, как более тяжелый гомолог висмута.
Согласно расчетам, элемент обладает некоторыми свойствами, схожими с более легкими гомологами: азотом, фосфором, мышьяком, сурьмой и висмутом. При этом демонстрирует несколько существенных отличий от них. На сегодня синтезировано около 100 атомов московия, которые имеют массовые числа от 287 до 290.

Физические свойства
Валентные электроны 115 элемента таблицы Менделеева московия делятся на три подоболочки: 7s (два электрона), 7p 1/2 (два электрона) и 7p 3/2 (один электрон). Первые два из них релятивистски стабилизируются и, следовательно, ведут себя, как инертные газы, а последние релятивистски дестабилизируются и могут легко участвовать в химических взаимодействиях. Таким образом, первичный потенциал ионизации московия должен составлять около 5,58 эВ. Согласно расчетам, moscovium должен быть плотным металлом из-за его высокого атомного веса с плотностью около 13,5 г/см 3 .
Предполагаемые расчетные характеристики:
- Фаза: твердая.
- Температура плавления: 400°С (670°К, 750°F).
- Точка кипения: 1100°С (1400°К, 2000°F).
- Удельная теплота плавления: 5,90-5,98 кДж/моль.
- Удельная теплота парообразования и конденсации: 138 кДж/моль.

Химические свойства
115-й элемент таблицы Менделеева стоит третьим в ряду химических элементов 7p и является самым тяжелым членом группы 15 в периодической таблице, располагаясь ниже висмута. Химическое взаимодействие московия в водном растворе обусловлено характеристиками ионов Mc + и Mc 3+ . Первые, предположительно, легко гидролизуются и образуют ионную связь с галогенами, цианидами и аммиаком. Гидроксид московия (I) (McOH), карбонат (Mc 2 CO 3), оксалат (Mc 2 C 2 O 4) и фторид (McF) должны растворяться в воде. Сульфид (Мс 2 S) должен быть нерастворимым. Хлорид (McCl), бромид (McBr), йодид (McI) и тиоцианат (McSCN) - слаборастворимые соединения.
Фторид московия (III) (McF 3) и тиозонид (McS 3), предположительно, нерастворимы в воде (аналогично соответствующим соединениям висмута). В то время, как хлорид (III) (McCl 3), бромид (McBr 3) и иодид (McI 3) должны быть легко растворимы и легко гидролизованы с образованием оксогалогенидов, таких как McOCl и McOBr (также аналогично висмуту). Оксиды московия (I) и (III) обладают схожими состояниями окисления, и их относительная стабильность в значительной степени зависит от того, с какими элементами они взаимодействуют.
Неопределенность
Вследствие того, что 115 элемент таблицы Менделеева синтезируется единичными экспериментально его точные характеристики проблематично. Ученым приходится ориентироваться на теоретические расчеты и сравнивать с более стабильными элементами, схожими по свойствам.
В 2011 году были проведены эксперименты по созданию изотопов нихония, флеровия и московия в реакциях между «ускорителями» (кальцием-48) и «мишенями» (америцием-243 и плутонием-244) для исследования их свойств. Однако «мишени» включали примеси свинца и висмута и, следовательно, были получены в реакциях переноса нуклонов некоторые изотопы висмута и полония, что осложнило проведение эксперимента. Между тем, полученные данные помогут в будущем ученым более детально исследовать тяжелые гомологи висмута и полония, такие как moscovium и livermorium.

Открытие
Первым успешным синтезом 115 элемента таблицы Менделеева была совместная работа российских и американских ученых в августе 2003 года в ОИЯИ в Дубне. В команду во главе с физиком-ядерщиком Юрием Оганесяном, помимо отечественных специалистов, вошли коллеги из Ливерморской национальной лаборатории Лоуренса. Исследователи 2 февраля 2004 года опубликовали в издании Physical Review информацию, что они бомбардировали америций-243 ионами кальция-48 на циклотроне У-400 и получили четыре атома нового вещества (одно ядро 287 Mc и три ядра 288 Mc). Эти атомы затухают (распадаются) за счет эмиссии альфа-частиц до элемента нихония примерно за 100 миллисекунд. Два более тяжелых изотопа московия, 289 Mc и 290 Mc, были обнаружены в 2009-2010 годах.
Первоначально IUPAC не могла утвердить открытие нового элемента. Требовалось подтверждение из других источников. В течение следующих нескольких лет была проведена еще одна оценка более поздних экспериментов, и еще раз выдвинуто заявление дубненской команды об открытии 115-го элемента.
В августе 2013 года группа исследователей из Университета Лунда и Института тяжелых ионов в Дармштадте (Германия) объявили, что они повторили эксперимент 2004 года, подтвердив результаты, полученные в Дубне. Еще одно подтверждение было опубликовано командой ученых, работавших в Беркли в 2015 году. В декабре 2015 года совместная рабочая группа IUPAC/IUPAP признала обнаружение этого элемента и отдала приоритет в открытии российско-американской команде исследователей.

Название
115 элемент таблицы Менделеева в 1979 году согласно рекомендации IUPAC было решено назвать «унунпентий» и обозначать соответствующим символом UUP. Несмотря на то, что данное название с тех пор широко использовалось в отношении неоткрытого (но теоретически предсказанного) элемента, в сообществе физиков оно не прижилось. Чаще всего вещество так и называли - элемент №115 или E115.
30 декабря 2015 года обнаружение нового элемента было признано Международным союзом чистой и прикладной химии. Согласно новым правилам, первооткрыватели имеют право предложить собственное название нового вещества. Сначала предполагалось назвать 115 элемент таблицы Менделеева «лангевиний» в честь физика Поля Ланжевена. Позднее команда ученых из Дубны, как вариант, предложила наименование «московий» в честь Московской области, где и было совершено открытие. В июне 2016 года IUPAC одобрил инициативу и 28 ноября 2016 официально утвердил название «moscovium».
Очень много различных вещей и предметов, живых и неживых тел природы нас окружает. И все они имеют свой состав, строение, свойства. В живых существах протекают сложнейшие биохимические реакции, сопровождающие процессы жизнедеятельности. Неживые тела выполняют различные функции в природе и жизни биомассы и имеют сложный молекулярный и атомарный состав.
Но все вместе объекты планеты имеют общую особенность: они состоят из множества мельчайших структурных частиц, называемых атомами химических элементов. Настолько мелких, что невооруженным взглядом их не рассмотреть. Что такое химические элементы? Какими характеристиками они обладают и откуда стало известно об их существовании? Попробуем разобраться.
Понятие о химических элементах
В общепринятом понимании химические элементы - это лишь графическое отображение атомов. Частиц, из которых складывается все существующее во Вселенной. То есть на вопрос "что такое химические элементы" можно дать такой ответ. Это сложные маленькие структуры, совокупности всех изотопов атомов, объединенные общим названием, имеющие свое графическое обозначение (символ).
На сегодняшний день известно о 118 элементах, которые открыты как в естественных условиях, так и синтетически, путем осуществления ядерных реакций и ядер других атомов. Каждый из них имеет набор характеристик, свое местоположение в общей системе, историю открытия и название, а также выполняет определенную роль в природе и жизни живых существ. Изучением этих особенностей занимается наука химия. Химические элементы - это основа для построения молекул, простых и сложных соединений, а следовательно, химических взаимодействий.
История открытия
Само понимание того, что такое химические элементы, пришло только в XVII веке благодаря работам Бойля. Именно он впервые заговорил об этом понятии и дал ему следующее определение. Это неделимые маленькие простые вещества, из которых складывается все вокруг, в том числе и все сложные.
До этой работы господствовали взгляды алхимиков, признававшим теорию четырех стихий - Эмпидокла и Аристотеля, а также открывших "горючие начала" (сера) и "металлические начала" (ртуть).
Практически весь XVIII век была распространена совершенно ошибочная теория флогистона. Однако уже в конце этого периода Антуан Лоран Лавуазье доказывает, что она несостоятельна. Он повторяет формулировку Бойля, но при этом дополняет ее первой попыткой систематизации всех известных на тот момент элементов, распределив их на четыре группы: металлы, радикалы, земли, неметаллы.

Следующий большой шаг в понимании того, что такое химические элементы, делает Дальтон. Ему принадлежит заслуга открытия атомной массы. На основе этого он распределяет часть известных химических элементов в порядке возрастания их атомной массы.
Стабильно интенсивное развитие науки и техники позволяет делать ряд открытий новых элементов в составе природных тел. Поэтому к 1869 году - времени великого творения Д. И. Менделеева - науке стало известно о существовании 63 элементов. Работа русского ученого стала первой полной и навсегда закрепившейся классификацией этих частиц.
Строение химических элементов на тот момент установлено не было. Считалось, что атом неделим, что это мельчайшая единица. С открытием явления радиоактивности было доказано, что он делится на структурные части. Практически каждый при этом существует в форме нескольких природных изотопов (аналогичных частиц, но с иным количеством структур нейтронов, от чего меняется атомная масса). Таким образом, к середине прошлого столетия удалось добиться порядка в определении понятия химического элемента.
Система химических элементов Менделеева
В основу ученый положил различие в атомной массе и сумел гениальным образом расположить все известные химические элементы в порядке ее возрастания. Однако вся глубина и гениальность его научного мышления и предвидения заключалась в том, что Менделеев оставил пустые места в своей системе, открытые ячейки для еще неизвестных элементов, которые, по мнению ученого, в будущем будут открыты.
И все получилось именно так, как он сказал. Химические элементы Менделеева с течением времени заполнили все пустые ячейки. Была открыта каждая предсказанная ученым структура. И теперь мы можем смело говорить о том, что система химических элементов представлена 118 единицами. Правда, три последних открытия пока еще официально не подтверждены.
Сама по себе система химических элементов отображается графически таблицей, в которой элементы располагаются согласно иерархичности их свойств, зарядам ядер и особенностям строения электронных оболочек их атомов. Так, имеются периоды (7 штук) - горизонтальные ряды, группы (8 штук) - вертикальные, подгруппы (главная и побочная в пределах каждой группы). Чаще всего отдельно в нижние слои таблицы выносятся два ряда семейств - лантаноиды и актиноиды.

Атомная масса элемента складывается из протонов и нейтронов, совокупность которым имеет название "массовое число". Количество протонов определяется очень просто - оно равно порядковому номеру элемента в системе. А так как атом в целом - система электронейтральная, то есть не имеющая вообще никакого заряда, то количество отрицательных электронов всегда равно количеству положительных частиц протонов.
Таким образом, характеристика химического элемента может быть дана по его положению в периодической системе. Ведь в ячейке описано практически все: порядковый номер, а значит, электроны и протоны, атомная масса (усредненное значение всех существующих изотопов данного элемента). Видно, в каком периоде находится структура (значит, на стольких слоях будут располагаться электроны). Также можно предсказать количество отрицательных частиц на последнем энергетическом уровне для элементов главных подгрупп - оно равно номеру группы, в которой располагается элемент.

Количество нейтронов можно рассчитать, если вычесть из массового числа протоны, то есть порядковый номер. Таким образом, можно получить и составить целую электронно-графическую формулу для каждого химического элемента, которая будет в точности отражать его строение и показывать возможные и проявляемые свойства.
Распространение элементов в природе
Изучением этого вопроса занимается целая наука - космохимия. Данные показывают, что распределение элементов по нашей планете повторяет такие же закономерности во Вселенной. Главным источником ядер легких, тяжелых и средних атомов являются ядерные реакции, происходящие в недрах звезд - нуклеосинтез. Благодаря этим процессам Вселенная и космическое пространство снабдили нашу планету всеми имеющимися химическими элементами.
Всего из известных 118 представителей в естественных природных источниках людьми были обнаружены 89. Это основополагающие, самые распространенные атомы. Химические элементы также были синтезированы искусственно, путем бомбардировки ядер нейтронами (нуклеосинтез в лабораторных условиях).

Самыми многочисленными считаются простые вещества таких элементов, как азот, кислород, водород. Углерод входит в состав всех органических веществ, а значит, также занимает лидирующие позиции.
Классификация по электронному строению атомов
Одна из самых распространенных классификаций всех химических элементов системы - это распределение их на основе электронного строения. По тому, сколько энергетических уровней входит в состав оболочки атома и который из них содержит последние валентные электроны, можно выделить четыре группы элементов.
S-элементы
Это такие, у которых последней заполняется s-орбиталь. К этому семейству относятся элементы первой группы главной подгруппы (или Всего один электрон на внешнем уровне определяет схожие свойства этих представителей как сильных восстановителей.
Р-элементы
Всего 30 штук. Валентные электроны располагаются на р-подуровне. Это элементы, формирующие главные подгруппы с третьей по восьмую группу, относящиеся к 3,4,5,6 периодам. Среди них по свойствам встречаются как металлы, так и типичные неметаллические элементы.
d-элементы и f-элементы
Это переходные металлы с 4 по 7 большой период. Всего 32 элемента. Простые вещества могут проявлять как кислотные, так и основные свойства (окислительные и восстановительные). Также амфотерные, то есть двойственные.
К f-семейству относятся лантаноиды и актиноиды, у которых последние электроны располагаются на f-орбиталях.
Вещества, образуемые элементами: простые
Также все классы химических элементов способны существовать в виде простых или сложных соединений. Так, простыми принято считать такие, которые образованы из одной и той же структуры в разном количестве. Например, О 2 - кислород или дикислород, а О 3 - озон. Такое явление носит название аллотропии.

Простые химические элементы, формирующие одноименные соединения, характерны для каждого представителя периодической системы. Но не все они одинаковы по проявляемым свойствам. Так, существуют простые вещества металлы и неметаллы. Первые образуют главные подгруппы с 1-3 группу и все побочные подгруппы в таблице. Неметаллы же формируют главные подгруппы 4-7 групп. В восьмую основную входят особые элементы - благородные или инертные газы.
Среди всех открытых на сегодня простых элементов известны при обычных условиях 11 газов, 2 жидких вещества (бром и ртуть), все остальные - твердые.
Сложные соединения
К таковым принято относить все, которые состоят из двух и более химических элементов. Примеров масса, ведь химических соединений известно более 2 миллионов! Это соли, оксиды, основания и кислоты, сложные комплексные соединения, все органические вещества.