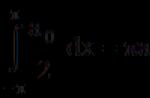В жизни мы сталкиваемся с разными химическими реакциями. Одни из них, как ржавление железа, могут идти несколько лет. Другие, например, сбраживание сахара в спирт, - несколько недель. Дрова в печи сгорают за пару часов, а бензин в моторе - за долю секунды.
Чтобы уменьшить затраты на оборудование, на химических заводах повышают скорость реакций. А некоторые процессы, например, порчу пищевых продуктов, коррозию металлов, - нужно замедлить.
Скорость химической реакции можно выразить как изменение количества вещества (n, по модулю) в единицу времени (t) - сравните скорость движущегося тела в физике как изменение координат в единицу времени: υ = Δx/Δt . Чтобы скорость не зависела от объема сосуда, в котором протекает реакция, делим выражение на объем реагирующих веществ (v), т. е. получаем изменение количества вещества в единицу времени в единице объема, или изменение концентрации одного из веществ в единицу времени :
n 2 − n 1 Δn
υ = –––––––––– = –––––––– = Δс/Δt (1)
(t 2 − t 1) v Δt v
где c = n / v - концентрация вещества,
Δ (читается «дельта») - общепринятое обозначение изменения величины.
Если в уравнении у веществ разные коэффициенты, скорость реакции для каждого из них, рассчитанная по этой формуле будет различной. Например, 2 моль серни́стого газа прореагировали полностью с 1 моль кислорода за 10 секунд в 1 литре:
2SO 2 + O 2 = 2SO 3
Скорость по кислороду будет: υ = 1: (10 1) = 0,1 моль/л·с
Скорость по серни́стому газу: υ = 2: (10 1) = 0,2 моль/л·с - это не нужно запоминать и говорить на экзамене, пример приведен для того, чтобы не путаться, если возникнет этот вопрос.
Скорость гетерогенных реакций (с участием твердых веществ) часто выражают на единицу площади соприкасающихся поверхностей:
Δn
υ = –––––– (2)
Δt S
Гетерогенными называются реакции, когда реагирующие вещества находятся в разных фазах:
- твердое вещество с другим твердым, жидкостью или газом,
- две несмешивающиеся жидкости,
- жидкость с газом.
Гомогенные реакции протекают между веществами в одной фазе:
- между хорошо смешивающимися жидкостями,
- газами,
- веществами в растворах.
Условия, влияющие на скорость химических реакций
1) Скорость реакции зависит от природы реагирующих веществ . Проще говоря, разные вещества реагируют с разной скоростью. Например, цинк бурно реагирует с соляной кислотой, а железо довольно медленно.
2) Скорость реакции тем больше, чем выше концентрация веществ. С сильно разбавленной кислотой цинк будет реагировать значительно дольше.
3) Скорость реакции значительно повышается с повышением температуры . Например, для горения топлива необходимо его поджечь, т. е. повысить температуру. Для многих реакций повышение температуры на 10° C сопровождается увеличением скорости в 2–4 раза.
4) Скорость гетерогенных реакций увеличивается с увеличением поверхности реагирующих веществ . Твердые вещества для этого обычно измельчают. Например, чтобы порошки железа и серы при нагревании вступили в реакцию, железо должно быть в виде мелких опилок.
Обратите внимание, что в данном случае подразумевается формула (1) ! Формула (2) выражает скорость на единице площади, следовательно не может зависеть от площади.
5) Скорость реакции зависит от наличия катализаторов или ингибиторов.
Катализаторы - вещества, ускоряющие химические реакции, но сами при этом не расходующиеся. Пример - бурное разложение перекиси водорода при добавлении катализатора - оксида марганца (IV):
2H 2 O 2 = 2H 2 O + O 2
Оксид марганца (IV) остается на дне, его можно использовать повторно.
Ингибиторы - вещества, замедляющие реакцию. Например, для продления срока службы труб и батарей в систему водяного отопления добавляют ингибиторы коррозии. В автомобилях ингибиторы коррозии добавляются в тормозную, охлаждающую жидкость.
Еще несколько примеров.
Скорость химической реакции
Тема «Скорость химической
реакции», пожалуй, наиболее сложная и
противоречивая в школьной программе. Это связано
со сложностью самой химической кинетики –
одного из разделов физической химии.
Неоднозначно уже само определение понятия
«скорость химической реакции» (см., например,
статью Л.С.Гузея в газете «Химия», 2001, № 28,
с. 12). Еще больше проблем возникает при попытке
применить закон действующих масс для скорости
реакции к любым химическим системам, ведь круг
объектов, для которых возможно количественное
описание кинетических процессов в рамках
школьной программы, очень узок. Хотелось бы особо
отметить некорректность использования закона
действующих масс для скорости химической
реакции при химическом равновесии.
В то же время вообще отказаться от рассмотрения
этой темы в школе было бы неверным. Представления
о скорости химической реакции очень важны при
изучении многих природных и технологических
процессов, без них невозможно говорить о
катализе и катализаторах, в том числе и о
ферментах. Хотя при обсуждении превращений
веществ используются в основном качественные
представления о скорости химической реакции,
введение простейших количественных соотношений
все же желательно, особенно для элементарных
реакций.
В публикуемой статье достаточно подробно
рассматриваются вопросы химической кинетики,
которые можно обсуждать на школьных уроках
химии. Исключение из курса школьной химии
спорных и противоречивых моментов этой темы
особенно важно для тех учащихся, кто собирается
продолжить свое химическое образование в вузе.
Ведь полученные в школе знания нередко вступают
в противоречие с научной реальностью.
Химические реакции могут существенно различаться по времени протекания. Смесь водорода и кислорода при комнатной температуре может долгое время оставаться практически без изменений, однако при ударе или поджигании произойдет взрыв. Железная пластина медленно ржавеет, а кусочек белого фосфора самовоспламеняется на воздухе. Важно знать, насколько быстро протекает та или иная реакция, чтобы иметь возможность контролировать ее ход.
Основные понятия
Количественной характеристикой того, насколько быстро протекает данная реакция, является скорость химической реакции, т. е. скорость расходования реагентов или скорость появления продуктов. При этом безразлично, о каком из участвующих в реакции веществе идет речь, поскольку все они связаны между собой через уравнение реакции. По изменению количества одного из веществ можно судить о соответствующих изменениях количеств всех остальных.
Скоростью химической реакции () называют изменение количества вещества реагента или продукта () за единицу времени () в единице объема (V ):
= /(V ).
Скорость реакции в данном случае обычно выражается в моль/(л с).
Приведенное выражение относится к гомогенным химическим реакциям, протекающим в однородной среде, например между газами или в растворе:
2SO 2 + O 2 = 2SO 3 ,
BаСl 2 + Н 2 SO 4 = ВаSО 4 + 2НСl.
Гетерогенные химические реакции идут на поверхности соприкосновения твердого вещества и газа, твердого вещества и жидкости и т.п. К гетерогенным реакциям относятся, например, реакции металлов с кислотами:
Fе + 2НСl = FeСl 2 + Н 2 .
В этом случае скоростью реакции называют изменение количества вещества реагента или продукта () за единицу времени () на единице поверхности (S):
= /(S ).
Скорость гетерогенной реакции выражается в моль/(м 2 с).
Чтобы управлять химическими реакциями, важно не только уметь определять их скорости, но и выяснить, какие условия оказывают на них влияние. Раздел химии, изучающий скорость химических реакций и влияние на нее различных факторов, называется химической кинетикой .
Частота соударений реагирующих частиц
Важнейший фактор, определяющий скорость химической реакции, – концентрация .
При повышении концентрации реагирующих веществ скорость реакции, как правило, возрастает. Для того чтобы вступить в реакцию, две химические частицы должны сблизиться, поэтому скорость реакции зависит от числа столкновений между ними. Увеличение числа частиц в данном объеме приводит к более частым столкновениям и к возрастанию скорости реакции.
Для гомогенных реакций повышение концентрации одного или нескольких реагирующих веществ приведет к увеличению скорости реакции. При понижении концентрации наблюдается противоположный эффект. Концентрация веществ в растворе может быть изменена путем добавления или удаления из сферы реакции реагирующих веществ или растворителя. В газах концентрация одного из веществ может быть увеличена путем введения дополнительного количества этого вещества в реакционную смесь. Концентрации всех газообразных веществ можно увеличить одновременно, уменьшая объем, занимаемый смесью. При этом скорость реакции возрастет. Увеличение объема приводит к обратному результату.
Скорость гетерогенных реакций зависит от площади поверхности соприкосновения веществ , т.е. от степени измельчения веществ, полноты смешивания реагентов, а также от состояния кристаллических структур твердых тел. Любые нарушения в кристаллической структуре вызывают увеличение реакционной способности твердых тел, т.к. для разрушения прочной кристаллической структуры требуется дополнительная энергия.
Рассмотрим горение древесины. Целое полено горит на воздухе сравнительно медленно. Если увеличить поверхность соприкосновения дерева с воздухом, расколов полено на щепки, скорость горения увеличится. Вместе с тем древесина горит в чистом кислороде значительно быстрее, чем на воздухе, который содержит лишь около 20% кислорода.
Для протекания химической реакции должно произойти столкновение частиц – атомов, молекул или ионов. В результате столкновений происходит перегруппировка атомов и возникают новые химические связи, что приводит к образованию новых веществ. Вероятность столкновения двух частиц достаточно высока, вероятность одновременного столкновения трех частиц существенно меньше. Одновременное столкновение четырех частиц чрезвычайно маловероятно. Поэтому большинство реакций протекает в несколько стадий, на каждой из которых происходит взаимодействие не более трех частиц.
Реакция окисления бромоводорода протекает с заметной скоростью при 400–600 °С:
4НВr + O 2 = 2Н 2 О + 2Вr 2 .
В соответствии с уравнением реакции одновременно должно столкнуться пять молекул. Однако вероятность такого события практически равна нулю. Более того, экспериментальные исследования показали, что повышение концентрации – либо кислорода, либо бромоводорода – увеличивает скорость реакции в одно и то же число раз. И это при том, что на каждую молекулу кислорода расходуется четыре молекулы бромоводорода.
Детальное рассмотрение данного процесса показывает, что он протекает в несколько стадий:
1) НBr + О 2 = НООВr (медленная реакция);
2) НООВr + НВr = 2НОВr (быстрая реакция);
3) НОВr + НВr = Н 2 О + Вr 2 (быстрая реакция).
Приведенные реакции, так называемые элементарные реакции , отражают механизм реакции окисления бромоводорода кислородом. Важно отметить, что в каждой из промежуточных реакций участвует только по две молекулы. Сложение первых двух уравнений и удвоенного третьего дает суммарное уравнение реакции. Общая же скорость реакции определяется наиболее медленной промежуточной реакцией, в которой взаимодействуют одна молекула бромоводорода и одна молекула кислорода.
Скорость элементарных реакций прямо пропорциональна произведению молярных концентраций с (с – это количество вещества в единице объема, с = /V ) реагентов, взятых в степенях, равных их стехиометрическим коэффициентам (закон действующих масс для скорости химической реакции). Это справедливо лишь для уравнений реакций, отражающих механизмы реальных химических процессов, когда стехиометрические коэффициенты перед формулами реагентов соответствуют числу взаимодействующих частиц.
По числу взаимодействующих в реакции молекул различают реакции мономолекулярные, бимолекулярные и тримолекулярные. Например, диссоциация молекулярного йода на атомы: I 2 = 2I – мономолекулярная реакция.
Взаимодействие йода с водородом: I 2 + Н 2 = 2HI – бимолекулярная реакция. Закон действующих масс для химических реакций разной молекулярности записывается по-разному.
Мономолекулярные реакции:
А = В + С,
= kc A ,
где k – константа скорости реакции.
Бимолекулярные реакции:
= kc A c В.
Тримолекулярные реакции:
= kc 2 A c В.
Энергия активации
Столкновение химических частиц приводит к химическому взаимодействию лишь в том случае, если сталкивающиеся частицы обладают энергией, превышающей некоторую определенную величину. Рассмотрим взаимодействие газообразных веществ, состоящих из молекул А 2 и В 2:
А 2 + В 2 = 2АВ.
В ходе химической реакции происходит перегруппировка атомов, сопровождающаяся разрывом химических связей в исходных веществах и образованием связей в продуктах реакции. При столкновении реагирующих молекул сначала образуется так называемый активированный комплекс , в котором происходит перераспределение электронной плотности, и лишь потом получается конечный продукт реакции:

Энергию, необходимую для перехода веществ в состояние активированного комплекса, называют энергией активации .
Активность химических веществ проявляется в низкой энергии активации реакций с их участием. Чем ниже энергия активации, тем выше скорость реакции. Например, в реакциях между катионами и анионами энергия активации очень мала, поэтому такие реакции протекают почти мгновенно. Если энергия активации велика, то очень малая часть соударений приводит к образованию новых веществ. Так, скорость реакции между водородом и кислородом при комнатной температуре практически равна нулю.
Итак, на скорость реакции оказывает влияние природа реагирующих веществ . Рассмотрим для примера реакции металлов с кислотами. Если опустить в пробирки с разбавленной серной кислотой одинаковые кусочки меди, цинка, магния и железа, можно увидеть, что интенсивность выделения пузырьков газообразного водорода, характеризующая скорость протекания реакции, для этих металлов существенно различается. В пробирке с магнием наблюдается бурное выделение водорода, в пробирке с цинком пузырьки газа выделяются несколько спокойнее. Еще медленнее протекает реакция в пробирке с железом (рис.). Медь вообще не вступает в реакцию с разбавленной серной кислотой. Таким образом, скорость реакции зависит от активности металла.
При замене серной кислоты (сильной кислоты) на уксусную (слабую кислоту) скорость реакции во всех случаях существенно замедляется. Можно сделать вывод, что на скорость реакции металла с кислотой влияет природа обоих реагентов – как металла, так и кислоты.
Повышение температуры приводит к увеличению кинетической энергии химических частиц, т.е. увеличивает число частиц, имеющих энергию выше энергии активации. При повышении температуры число столкновений частиц также увеличивается, что в некоторой степени увеличивает скорость реакции. Однако повышение эффективности столкновений за счет увеличения кинетической энергии оказывает большее влияние на скорость реакции, чем увеличение числа столкновений.
При повышении температуры на десять градусов скорость увеличивается в число раз, равное температурному коэффициенту скорости :
= T +10 /T .
При повышении температуры от T
до T
"
отношение скоростей реакций T
" и T
равно
температурному коэффициенту скорости в степени (T
"
– T
)/10:
T " /T = (T "–T )/10.
Для многих гомогенных реакций температурный коэффициент скорости равен 24 (правило Вант-Гоффа). Зависимость скорости реакции от температуры можно проследить на примере взаимодействия оксида меди(II) с разбавленной серной кислотой. При комнатной температуре реакция протекает очень медленно. При нагревании реакционная смесь быстро окрашивается в голубой цвет за счет образования сульфата меди(II):
СuО + Н 2 SО 4 = СuSO 4 + Н 2 О.
Катализаторы и ингибиторы
Многие реакции можно ускорить или замедлить путем введения некоторых веществ. Добавляемые вещества не участвуют в реакции и не расходуются в ходе ее протекания, но оказывают существенное влияние на скорость реакции. Эти вещества изменяют механизм реакции (в том числе состав активированного комплекса) и понижают энергию активации, что обеспечивает ускорение химических реакций. Вещества – ускорители реакций называют катализаторами , а само явление такого ускорения реакции – катализом .
Многие реакции в отсутствие катализаторов протекают очень медленно или не протекают совсем. Одной из таких реакций является разложение пероксида водорода:
2Н 2 О 2 = 2Н 2 О + О 2 .
Если опустить в сосуд с водным раствором пероксида водорода кусочек твердого диоксида марганца, то начнется бурное выделение кислорода. После удаления диоксида марганца реакция практически прекращается. Путем взвешивания нетрудно убедиться, что диоксид марганца в данном процессе не расходуется – он лишь катализирует реакцию.
В зависимости от того, в одинаковых или различных агрегатных состояниях находится катализатор и реагирующие вещества, различают гомогенный и гетерогенный катализ.
При гомогенном катализе катализатор может ускорить реакцию путем образования промежуточных веществ за счет взаимодействия с одним из исходных реагентов. Например:
![]()
При гетерогенном катализе химическая реакция обычно протекает на поверхности катализатора:
![]()
Катализаторы широко распространены в природе. Практически все превращения веществ в живых организмах протекают с участием органических катализаторов – ферментов.
Катализаторы используют в химическом производстве для ускорения тех или иных процессов. Кроме них применяют также вещества, замедляющие химические реакции, – ингибиторы . С помощью ингибиторов, в частности, защищают металлы от коррозии.
Факторы, влияющие на скорость химической реакции
| Увеличивают скорость | Уменьшают скорость |
|---|---|
| Наличие химически активных реагентов | Наличие химически неактивных реагентов |
| Повышение концентрации реагентов | Понижение концентрации реагентов |
| Увеличение поверхности твердых и жидких реагентов | Уменьшение поверхности твердых и жидких реагентов |
| Повышение температуры | Понижение температуры |
| Присутствие катализатора | Присутствие ингибитора |
ЗАДАНИЯ
1. Дайте определение скорости химической реакции. Напишите выражение кинетического закона действующих масс для следующих реакций:
а) 2С (тв.) + О 2 (г.) = 2СО (г.);
б) 2НI (г.) = Н 2 (г.) + I 2 (г.).
2. От чего зависит скорость химической реакции? Приведите математическое выражение зависимости скорости химической реакции от температуры.
3. Укажите, как влияет на скорость реакции (при постоянном объеме):
а) увеличение концентрации реагентов;
б) измельчение твердого реагента;
в) понижение температуры;
г) введение катализатора;
д) уменьшение концентрации реагентов;
е) повышение температуры;
ж) введение ингибитора;
з) уменьшение концентрации продуктов.
4. Рассчитайте скорость химической реакции
СО (г.) + Н 2 О (г.) = СО 2 (г.) + Н 2 (г.)
в сосуде емкостью 1 л, если через 1 мин 30 с после ее начала количество вещества водорода было 0,32 моль, а через 2 мин 10 с стало 0,44 моль. Как повлияет на скорость реакции увеличение концентрации СО?
5. В результате одной реакции за определенный промежуток времени образовалось 6,4 г йодоводорода, а в другой реакции в тех же условиях – 6,4 г диоксида серы. Сравните скорости этих реакций. Как изменятся скорости этих реакций при повышении температуры?
6. Определите скорость реакции
СО (г.) + Сl 2 (г.) = СОCl 2 (г.),
если через 20 с после начала реакции исходное
количество вещества оксида углерода(II)
уменьшилось c 6 моль в 3 раза (объем реактора равен
100 л). Как изменится скорость реакции, если вместо
хлора использовать менее активный бром? Как
изменится скорость реакции при введении
а) катализатора; б) ингибитора?
7. В каком случае реакция
СaО (тв.) + СО 2 (г.) = СaCO 3 (тв.)
протекает быстрее: при использовании крупных
кусков или порошка оксида кальция? Рассчитайте:
а) количество вещества; б) массу карбоната
кальция, образовавшегося за 10 с, если скорость
реакции составляет 0,1 моль/(л с), объем реактора
равен 1 л.
8. Взаимодействие образца магния с хлороводородной кислотой НСl позволяет получить 0,02 моль хлорида магния через 30 с после начала реакции. Определите, за какое время можно получить 0,06 моль хлорида магния.
Е) от 70 до 40 °С скорость реакции уменьшилась в 8
раз;
ж) от 60 до 40 °С скорость реакции уменьшилась в
6,25 раза;
з) от 40 до 10 °С скорость реакции уменьшилась в 27
раз.
11. Владелец автомашины покрасил ее новой краской, а затем обнаружил, что согласно инструкции она должна сохнуть 3 ч при 105 °С. За какое время высохнет краска при 25 °С, если температурный коэффициент реакции полимеризации, лежащей в основе этого процесса, равен: а) 2; б) 3; в) 4?
ОТВЕТЫ НА ЗАДАНИЯ
1. а) = kc (О 2); б) = kc (HI) 2 .
2. T +10 = T .
3. Скорость реакции увеличивается в случаях а, б, г, е; уменьшается – в, д, ж; не изменяется – з.
4. 0,003 моль/(л с). При увеличении концентрации СО скорость реакции возрастает.
5. Скорость первой реакции в 2 раза ниже.
6. 0,002 моль/(л с).
7. а) 1 моль; б) 100 г.
9. Увеличатся в 2 раза скорости реакций д, ж, з; в 4 раза – а, б, е; в 8 раз – в, г.
10. Температурный коэффициент:
2 для реакций б, е; = 2,5 – в, ж; = 3 – д, з; = 3,5 – а, г.
а) 768 ч (32 сут, т. е. более 1 месяца);
б) 19 683 ч (820 сут, т. е. более 2 лет);
в) 196 608 ч (8192 сут, т. е. 22 года).
Химические методы
Физические методы
Методы измерения скорости реакции
В приведенном выше примере скорость реакции между карбонатом кальция и кислотой измеряли путем изучения зависимости объема выделившегося газа от времени. Опытные данные о скоростях реакций можно получать измерением других величин.
Если в ходе реакции изменяется общее количество газообразных веществ, то за ее протеканием можно наблюдать, измеряя давление газа при постоянном объеме. В тех случаях, когда одно из исходных веществ или один из продуктов реакции окрашены, за ходом реакции можно следить, наблюдая изменение окраски раствора. Другим оптическим методом является измерение вращения плоскости поляризации света (если исходные вещества и продукты реакции обладают различной вращающей способностью).
Некоторые реакции сопровождаются изменением числа ионов в растворе. В таких случаях скорость реакции можно изучать путем измерения электрической проводимости раствора. В следующей главе будут рассмотрены некоторые другие электрохимические методы, которые могут быть использованы для измерения скоростей реакций.
За ходом реакции можно следить, измеряя во времени концентрацию одного из участников реакции с помощью разнообразных методов химического анализа. Реакцию проводят в термостатированном сосуде. Через определенные промежутки времени из сосуда отбирают пробу раствора (или газа) и определяют концентрацию одного из компонентов. Для получения надежных результатов важно, чтобы в пробе, отобранной для анализа, реакция не происходила. Это достигается путем химического связывания одного из реагентов, резким охлаждением или разбавлением раствора.
Экспериментальные исследования показывают, что скорость реакции зависит от нескольких факторов. Рассмотрим влияние этих факторов вначале на качественном уровне.
1.Природа реагирующих веществ. Из лабораторной практики мы знаем, что нейтрализация кислоты основанием
Н + + ОН – ® Н 2 О
взаимодействие солей с образованием малорастворимого соединения
Ag + + Cl – ® AgCl
и другие реакции в растворах электролитов происходят очень быстро. Время, необходимое для завершения таких реакций, измеряется в миллисекундах и даже в микросекундах. Это вполне понятно, т.к. сущность таких реакций состоит в сближении и соединении заряженных частиц с зарядами противоположного знака.
В противоположность ионным реакциям взаимодействие между ковалентно связанными молекулами обычно протекает гораздо медленнее. Ведь в ходе реакции между такими частицами должен произойти разрыв связей в молекулах исходных веществ. Для этого сталкивающиеся молекулы должны обладать определенным запасом энергии. Кроме того,если молекулы достаточно сложны, для того, чтобы произошла между ними реакция, они должны быть определенным образом ориентированы в пространстве.
2. Концентрация реагирующих веществ . Скорость химической реакции, при прочих равных условиях, зависит от числа столкновений реагирующих частиц в единицу времени. Вероятность столкновений зависит от количества частиц в единице объема, т.е. от концентрации. Поэтому скорость реакции увеличивается с повышением концентрации.
3. Физическое состояние веществ . В гомогенных системах скорость реакции зависит от числа столкновений частиц в объеме раствора (или газа). В гетерогенных системах химическое взаимодействие происходит на поверхности раздела фаз . Увеличение площади поверхности твердого вещества при его измельчении облегчает доступ реагирующих частиц к частицам твердого вещества, что приводит к существенному ускорению реакции.
4. Температура оказывает существенное влияние на скорость разнообразных химических и биологических процессов. При увеличении температуры повышается кинетическая энергия частиц, а, следовательно, увеличивается доля частиц, энергия которых достаточна для химического взаимодействия.
5. Стерический фактор характеризует необходимость взаимной ориентации реагирующих частиц. Чем сложнее молекулы, тем меньше вероятность их должной ориентации, тем меньше эффективность столкновений.
6. Наличие катализаторов . Катализаторами называются вещества, в присутствии которых изменяется скорость химической реакции. Вводимые в реакционную систему в небольших количествах и остающиеся после реакции неизменившимися, они способны чрезвычайно менять скорость процесса.
Основные факторы, от которых зависит скорость реакции, будут подробнее рассмотрены ниже.
Цель работы: изучение скорости химической реакции и ее зависимости от различных факторов: природы реагирующих веществ, концентрации, температуры.
Химические реакции протекают с различной скоростью. Скоростью химической реакции называют изменением концентрации реагирующего вещества в единицу времени. Она равно числу актов взаимодействия в единицу времени в единице объёма для реакции, протекающих в гомогенной системе (для гомогенных реакций), или на единице поверхности раздела фаз для реакций, протекающих в гетерогенной системе (для гетерогенных реакций).
Средняя скорость реакции v ср . в интервале времени от t 1 до t 2 определяется отношением:
где С 1 и С 2 – молярная концентрация любого участника реакции в моменты времени t 1 и t 2 соответственно.
Знак “–“ перед дробью относиться к концентрации исходных веществ, ΔС < 0, знак “+” – к концентрации продуктов реакции, ΔС > 0.
Основные факторы, влияющие на скорость химической реакции: природа реагирующих веществ, их концентрация, давление (если в реакции участвуют газы), температура, катализатор, площадь поверхности раздела фаз для гетерогенных реакций.
Большинство химических реакций представляют собой сложные процессы, протекающие в несколько стадий, т.е. состоящие из нескольких элементарных процессов. Элементарные или простые реакции – это реакции, протекающие в одну стадию.
Для элементарных реакций зависимость скорости реакции от концентрации выражается законом действия масс.
При постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам.
Для реакции в общем виде
а А + b В… → с С,
cогласно закону действия масс v выражается соотношением
v = К∙с(А) а ∙ с(В) b ,
где с(А) и с(В) – молярные концентрации реагирующих веществ А и В;
К – константа скорости данной реакции, равная v , если с(А) а =1 и с(В) b =1, и зависящая от природы реагирующих веществ, температуры, катализатора, площади поверхности раздела фаз для гетерогенных реакций.
Выражение зависимости скорости реакции от концентрации называют кинетическим уравнением.
В случае сложных реакций закон действия масс применим к каждой отдельной стадии.
Для гетерогенных реакций в кинетическое уравнение входят только концентрации газообразных и растворенных веществ; так, для горения угля
С (к) + О 2 (г) → СО 2 (г)
уравнение скорости имеет вид
v = К∙с(О 2)
Несколько слов о молекулярности и кинетическом порядке реакции.
Понятие «молекулярность реакции» применяют только к простым реакциям. Молекулярность реакции характеризует число частиц, участвующих в элементарном взаимодействии.
Различают моно-, би- и тримолекулярные реакции, в которых участвуют соответственно одна, две и три частицы. Вероятность одновременного столкновения трех частиц мала. Элементарный процесс взаимодействия более чем трех частиц неизвестен. Примеры элементарных реакций:
N 2 O 5 → NO + NO + O 2 (мономолекулярная)
H 2 + I 2 → 2HI (бимолекулярная)
2NO + Cl 2 → 2NOCl (тримолекулярная)
Молекулярность простых реакций совпадает с общим кинетическим порядком реакции. Порядок реакции определяет характер зависимости скорости от концентрации.
Общий (суммарный) кинетический порядок реакции – сумма показателей степеней при концентрациях реагирующих веществ в уравнении скорости реакции, определенная экспериментально.
С повышением температуры скорость большинства химических реакций увеличивается. Зависимость скорости реакции от температуры приближено определяется правилом Вант-Гоффа.
При повышении температуры на каждые 10 градусов скорость большинства реакций увеличивается в 2–4 раза.
где и – скорость реакции соответственно при температурах t 2 и t 1 (t 2 >t 1 );
γ – температурный коэффициент скорости реакции, это число, показывающее, во сколько раз увеличивается скорость химической реакции при увеличении температуры на 10 0 .
С помощью правила Вант-Гоффа возможно лишь примерно оценить влияние температуры на скорость реакции. Более точное описание зависимости скорости реакции температуры осуществимо в рамках теории активации Аррениуса.
Одним из методов ускорения химической реакции является катализ, который осуществляется при помощи веществ (катализаторов).
Катализаторы – это вещества, которые изменяют скорость химической реакции вследствие многократного участия в промежуточном химическом взаимодействии с реагентами реакции, но после каждого цикла промежуточного взаимодействия восстанавливают свой химический состав.
Механизм действия катализатора сводится к уменьшению величины энергии активации реакции, т.е. уменьшению разности между средней энергией активных молекул (активного комплекса) и средней энергией молекул исходных веществ. Скорость химической реакции при этом увеличивается.
Скорость химической реакции зависит от многих факторов, включая природу реагирующих веществ, концентрацию реагирующих веществ, температуру, наличие катализаторов. Рассмотрим эти факторы.
1). Природа реагирующих веществ . Если идёт взаимодействие между веществами с ионной связью, то реакция протекает быстрее, чем между веществами с ковалентной связью.
2.) Концентрация реагирующих веществ . Чтобы прошла химическая реакция, необходимо столкновение молекул реагирующих веществ. То есть молекулы должны настолько близко подойти друг к другу, чтобы атомы одной частицы испытывали на себе действие электрических полей другой. Только в этом случае будут возможны переходы электронов и соответствующие перегруппировки атомов, в результате которых образуются молекулы новых веществ. Таким образом, скорость химических реакций пропорциональна числу столкновений, которое происходит между молекулами, а число столкновений, в свою очередь, пропорционально концентрации реагирующих веществ. На основании экспериментального материала норвежские учёные Гульдберг и Вааге и независимо от них русский учёный Бекетов в 1867 году сформулировали основной закон химической кинетики – закон действующих масс (ЗДМ): при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степени их стехиометрических коэффициентов. Для общего случая:
закон действующих масс имеет вид:
![]()
Запись закона действующих масс для данной реакции называют основным кинетическим уравнением реакции . В основном кинетическом уравнении k – константа скорости реакции, которая зависит от природы реагирующих веществ и температуры.
Большинство химических реакций является обратимыми. В ходе таких реакций продукты их по мере накопления реагируют друг с другом с образованием исходных веществ:
Скорость прямой реакции:
![]()
Скорость обратной реакции:
![]()
В момент равновесия:
Отсюда закон действующих масс в состоянии равновесия примет вид:
![]() ,
,
где K – константа равновесия реакции.
3) Влияние температуры на скорость реакции . Скорость химических реакций, как правило, при превышении температуры возрастает. Рассмотрим это на примере взаимодействия водорода с кислородом.
2Н 2 + О 2 = 2Н 2 О
При 20 0 С скорость реакции практически равна нулю и понадобилось бы 54 млрд.лет, чтобы взаимодействие прошло на 15%. При 500 0 С для образования воды потребуется 50 минут, а при 700 0 С реакция протекает мгновенно.
Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа : при увеличении температуры на 10 о скорость реакции увеличивается в 2 – 4 раза. Правило Вант-Гоффа записывается:
4) Влияние катализаторов . Скорость химических реакций можно регулировать с помощью катализаторов – веществ, изменяющих скорость реакции и остающихся после реакции в неизменном количестве. Изменение скорости реакции в присутствии катализатора называется катализом. Различают положительный (скорость реакции увеличивается) и отрицательный (скорость реакции уменьшается) катализ. Иногда катализатор образуется в ходе реакции, такие процессы называют автокаталитическими. Различают гомогенный и гетерогенный катализ.
При гомогенном катализе катализатор и реагирующие вещества находятся в одной фазе. Например:
При гетерогенном катализе катализатор и реагирующие вещества находятся в разных фазах. Например:
Гетерогенный катализ связан с ферментативными процессами. Все химические процессы, протекающие в живых организмах, катализируются ферментами, которые представляют собой белки с определёнными специализированными функциями. В растворах, в которых идут ферментативные процессы, нет типичной гетерогенной среды, в связи с отсутствием чётко выраженной поверхности раздела фаз. Такие процессы относят к микрогетерогенному катализу.